将Na2O2和NaHCO3固体混合物置于密闭容器中加热充分反应 放出气体后冷却。加热时可能发生的反应
| 将Na2O2和NaHCO3固体混合物置于密闭容器中加热充分反应,放出气体后冷却。加热时可能发生的反应如下: 2Na2O2+2NaHCO3 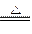 2NaOH+2Na2CO3+O2↑ 2NaOH+2Na2CO3+O2↑2Na2O2+4NaHCO3 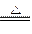 4Na2CO3+O2↑+2H2O 4Na2CO3+O2↑+2H2O2NaHCO3 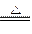 Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O(1)若固体混合物的质量为m,反应后冷却再称其质量减少了Δm。设NaHCO3、Na2O2的物质的量分别为a、b,试确定下列条件下Δm的取值范围(用含m的代数式表示)。 ①当a/b≤1时,Δm取值范围是_____________________。 ②当1<a/b≤2时,Δm取值范围是___________________。 ③当a/b>2时,Δm取值范围是______________________。 (2)若m="14.52" g,Δm=" 1.28" g时,向反应后的残留固体内滴加2.00 mol·L-1盐酸140.0 mL,可产生标准状况下的气体____________ L。 |
参考解答
(1)①Δm≤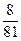 m m② 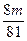 <Δm≤ <Δm≤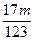 ③ 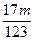 <Δm< <Δm<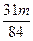 (2)2.016 |
| (1)①当a/b≤1时,反应按下式进行,Δm=m(O2)。则 2Na2O2+2NaHCO3 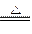 2NaOH+2Na2CO3+O2↑ 2NaOH+2Na2CO3+O2↑2×78+2×84 32 m Δm Δm≤ 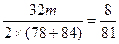 m m②当1<a/b≤2时,反应在上式基础上将按下式进行,Δm=m(O2)+m(H2O),则 2Na2O2+4NaHCO3 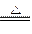 4Na2CO3+O2↑+2H2O 4Na2CO3+O2↑+2H2O2×7 84×84 32+36 m Δm 因此 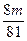 <Δm≤ <Δm≤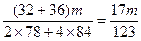 ③当a/b>2时,同理可求得 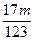 <Δm< <Δm<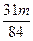 。 。(2)因为 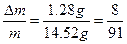 ,属a/b<1的情况,Na2O2过量,则Δm=m(O2),n(O2)= ,属a/b<1的情况,Na2O2过量,则Δm=m(O2),n(O2)=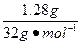 ='0.04' mol。 ='0.04' mol。2Na2O2+2NaHCO3 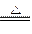 2NaOH + 2Na2CO3+O2↑ 2NaOH + 2Na2CO3+O2↑0.08 mol 0.08 mol 0.08 mol 0.04 mol 混合物中n(Na2O2)= 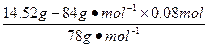 ='0.1' mol ='0.1' mol因此,残留固体内还有n(Na2O2)='0.1' mol-0.08 mol='0.02' mol, n(NaOH)='0.08' mol,n(Na2CO3)='0.08' mol,滴加n(HCl)='2.00' mol·L-1×0.140 L='0.280' mol时,发生的反应有: 2Na2O2+2H2O====4NaOH+O2↑ 0.02 mol 0.04 mol 0.01 mol NaOH + HCl====NaCl+H2O (0.04+0.08) mol 0.12 mol Na2CO3+HCl====NaCl+NaHCO3 0.08 mol 0.08 mol 0.08 mol NaHCO3+HCl====NaCl+H2O+CO2↑ 0.08 mol 0.08 mol 0.08 mol 所以,可产生标准状况下的气体V='(0.08+0.01)' mol×22.4 L·mol-1='2.016' L。 |
相似问题
下列说法不正确的是( )A.用倾析法分离时 将烧杯中的上层清液用玻璃棒引流到另一容器内 即可使沉淀
下列说法不正确的是( )A.用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离B.做“钠与水的反应”实验时,切取
Na2CO3和NaHCO3的混合物共19 g 与足量的盐酸反应生成的CO2气体通过足量的Na2O2后
Na2CO3和NaHCO3的混合物共19 g,与足量的盐酸反应生成的CO2气体通过足量的Na2O2后,得到3 2 g气体,求混合物中Na2CO3和NaHCO3的质量各为多少。
下列物质中 既可与盐酸反应 又可与氢氧化钠溶液反应的是( )A.Ba(OH)2B.Na2SO3
下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )A.Ba(OH)2B.Na2SO3C.NaHCO3D.NH4NO3
取对水蒸气的相对密度为0.4的CO和H2组成的混合气体若干克 通入到盛足量的Na2O2固体粉末的容器
取对水蒸气的相对密度为0 4的CO和H2组成的混合气体若干克,通入到盛足量的Na2O2固体粉末的容器中,并同时加入少量的O2,电火花引燃,充分反应后,称重发
在120℃时 将气体A 3.88 g通过足量的 放出 充分反应后固体的质量增加2.28 g 试通过计
在120℃时,将气体A 3 88 g通过足量的,放出,充分反应后固体的质量增加2 28 g,试通过计算判断气体 A的组成及各成分的质量。












