碳酸钠俗称纯碱 其用途很广。实验室中 用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。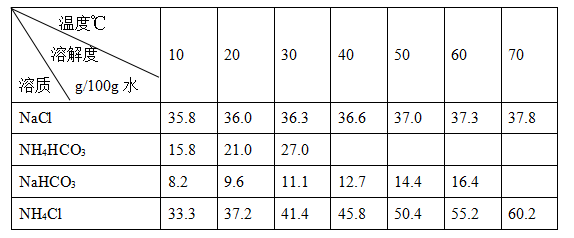
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,a 、b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1mL。此时发生的反应为:
CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含NaHCO3 。
参考解答
| (1)Ca2+、Mg2+ (2)Na++HCO3-→NaHCO3↓ (3)水浴加热;温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小 (4)过滤洗涤 (5)①Na2CO3%=(106cV1×10-3)/G ②黄色变为橙色且半分钟不变;V2>V1则含有NaHCO3 |
| (1)足量NaOH可以除去Mg2+;Na2CO3可以除去Ca2+; (2)Na++HCO3-→NaHCO3↓ (3)根据水浴加热,温度易控制且受热均匀;温度过高造成NH4HCO3分解,温度过低,NH4HCO3的溶解度小; (4)NH4HCO3与NaCl反应生成NaHCO3,便有晶体析出,然后过滤、洗涤可得到NaHCO3。 (5)①酚酞做指示剂,用浓度为cmol/LHCl溶液滴定至溶液由红色变成无色,说明CO32-+H+→HCO3-反应达到终点,所用盐酸的体积为V1mL,则碳酸钠的质量为106cV1×10-3g,其质量分数是(106cV1×10-3)/G。 ②用甲基橙做指示剂,继续用HCl滴定至溶液由黄色变成橙色,则HCO3-+H+=CO2+H2O反应达到终点,所用HCl的体积为V2,如果V1=V2,只有Na2CO3;如果V2>V1,则含有NaHCO3。 |
相似问题
下列实验的现象与对应结论均正确的是
下列实验的现象与对应结论均正确的是
下列反应与Na2O2+SO2→Na2SO4相比较 Na2O2的作用相同的是A.2Na2O2+2CO2
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是A.2Na2O2+2CO2→2Na2CO3+O2B.2Na2O2+2SO3→2Na2SO4+O2C.2Na2O2+H2SO4→Na2SO4+H2O2D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
下列对于过氧化钠的叙述中 正确的是( )A.将少量Na2O2投入紫色石蕊试液中 溶液最终呈蓝色B.
下列对于过氧化钠的叙述中,正确的是()A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色B.1 mol Na2O2与H2O完全反应,转移2 mol电子C.充分加热
现有钠 镁 铝各1 mol 使其分别与100 mL 5.0 mol/L的盐酸充分反应 所得同温同压下
现有钠、镁、铝各1mol,使其分别与100mL5 0mol L的盐酸充分反应,所得同温同压下的氢气体积的关系正确的是 [ ]A.氢气的体积相同 B.铝产生氢气最多,
现有25 mL 2 mol·L-1 Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2
现有25 mL 2 mol·L-1 Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中;②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产












