下图所示装置中 甲 乙 丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液 足量的CuSO4溶
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。 |
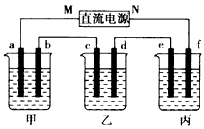 |
| (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10. 47%,乙中c电极质量增加。据此回答问题: ①电源的N端为_________极; ②电极b上发生的电极反应为______________________; ③列式计算电极b上生成的气体在标准状况下的体积:_____________________ ④电极c的质量变化是______________________g; ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液________________________ 乙溶液________________________ 丙溶液________________________ (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? _______________________________ |
参考解答
(1)①正;②4OH--4e-==2H2O+O2;③水减少的质量: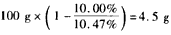 ,生成O2体积: ,生成O2体积: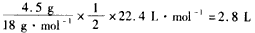 ;④16; ;④16;⑤甲溶液:碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大 乙溶液:酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加 丙溶液:酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性 (2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应 |
相似问题
把分别盛有熔融的氯化钾 氯化镁 氧化铝的三个电解槽串联 在一定条件下通电一段时间后 析出钾 镁 铝的
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 [ ]A.1∶2∶3B.3∶2∶1 C
研究化学反应原理对于生产生活是很有意义的。(1)25℃时 醋酸溶液中CH3COOHCH3COO-+
研究化学反应原理对于生产生活是很有意义的。(1)25℃时,醋酸溶液中CH3COOHCH3COO-+ H+;Ka= 1 75×10-5 mol L,若向0 10 mol LCH3COOH溶 液中加入
X Y Z L M五种元素的原子序数依次增大。x Y z L是组成蛋白质的基础元素 M是地壳中含量最
X、Y、Z、L、M五种元素的原子序数依次增大。x、Y、z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。请回答下列问题(1)M在元素周期表中的位
下列关于电解的说法中 正确的是 [ ]A.电解池是把化学能转变为电能的装置 B.电解精炼铜时
下列关于电解的说法中,正确的是 [ ]A.电解池是把化学能转变为电能的装置 B.电解精炼铜时,粗铜板做阴极 C.电镀时,通常把待镀的金属制品做阴极
三氧化二镍(Ni2O3)可用于制造高能电池 其电解法制备过程如下:用NaOH调NiCl2溶液pH至7
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7 5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件












