现在普遍应用的工业合成氨的方法是哈伯于1905年发明的 但此法反应物的转化率不高。(1)已知:1 m
| 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。 (1)已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式:____________________。 (2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2 (填“>” “=” 或 “<” )。 (3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2及固体催化剂。 10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率为:____________。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:__________________(任意写一条)。 (4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中______(填“大”、“小”或“相等”)。 (5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。 |
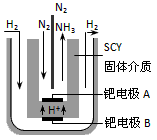 |
| 请回答:在电解法合成氨的电解池中______(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是__________________。钯电极A是电解池的______极(填“阳”或“阴”),该极上的电极反应式是__________________。 |
参考解答
| (1)N2(g)+3H2(g) = 2NH3(g) △H=-92.2 kJ·mol-1 (2)> (3)25% ;0.01mol/(L·min);增大氢气浓度或增大氮气浓度或增大反应物浓度或降温或增大压强或及时转移走生成的氨(答案合理即可) (4)相等 (5)不能;新法合成氨电解池的反应温度是570℃时,水为水蒸气;阴;N2+6e-+6H+=2NH3 |
相似问题
用惰性电极电解下列各溶液 经一段时间后 溶液的浓度增大 而溶液pH值保持不变的是( )A.CuCl
用惰性电极电解下列各溶液,经一段时间后,溶液的浓度增大,而溶液pH值保持不变的是( )A.CuCl2溶液B.NaCl溶液C.H2SO4溶液D.Na2SO4溶液
为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生 下列设计方案正确的是[ ]A.
为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是[ ]A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池 B.用铜
下列叙述正确的是 [ ]A.电解饱和食盐水制烧碱时 Fe作阳极 石墨作阴极 B.电解氯化铜时
下列叙述正确的是 [ ]A.电解饱和食盐水制烧碱时,Fe作阳极,石墨作阴极 B.电解氯化铜时,阳极上产生的气体质量和阴极上析出的铜的质量相等 C.钢铁
电解原理在化学工业中有广泛应用.如图表示一个电解池 装有电解液a;X Y是两块电极板 通过导线与直流
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性
下列有关原电池和电解池的叙述中正确的是( )A.钢管大部分浸在淡水中 主要发生析氢腐蚀B.钢管若采
下列有关原电池和电解池的叙述中正确的是( )A.钢管大部分浸在淡水中,主要发生析氢腐蚀B.钢管若采用外加电流的阴极保护措施,应当与电源的正极相












