Q W X Y Z是5种短周期元素 原子序数逐渐增大 Q是周期表中原子半径最小的元素 Q与W组成的化
| Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物. (1)W在元素周期表中的位置是______,Z2Y的电子式是______. (2)①已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断如下反应2WY(g)=2W(s)+Y2(g)△H>0,在常温下______自发进行(填“能”或“不能”). ②400℃时,在0.5L的反应容器中用X2、Q2反应合成XQ3反应,达到平衡时,测得X2、Q2、XQ3的物质的量分别为2mol、1mol、2mol,则此反应在400℃时的化学平衡常数为______ (3)2.24L(标准状况)XQ3被200mL 1mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是______. (4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______ (5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______. 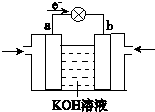 |
参考解答
| Q是周期表中原子半径最小的元素,应为H,Q与W组成的化合物是一种温室气体,该气体为CH4,则W为C,W与Y、X与Y组成的化合物是机动车排出的大气污染物,为CO和NOx,则Y为O,X为N,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物,这两种离子化合物分别为Na2O、Na2O2,作为Z为Na,则 (1)W为C,原子序数为6,原子核外有2个电子层,最外层电子数为6,应位于周期表第二周期IVA族, Z2Y为Na2O,为离子化合物,电子式为 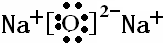 , 故答案为:第二周期IVA族; 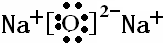 ; (2)①由自由能判据△G=△H-T?△S,可知当△H<T?△S时反应才能自发进行,即必须在较高的温度下才可以进行,化学反应能否自发进行取决于焓变和熵变的综合判据,不能只由焓变或熵变来决定,故答案为:不能; ②达平衡时,各物质的浓度分别为:c(N2)=4mol/L,c(H2)=2mol/L,c(NH3)=4mol/L, 则k=
(3)n(NH3)=
故答案为:c(NO3-)>c(H+)>c(NH4+)>c(OH-); (4)CH3OH碱性燃料电池中,CH3OH为电池的负极反应,被氧化,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O, 故答案为:CH3OH+8OH--6e-=CO32-+6H2O; (5)X和Z组成的一种离子化合物为Na3N,能与水反应生成两种碱,生成物为NaOH和NH3?H2O,反应的化学方程式为Na3N+4H2O=3NaOH+NH3?H2O, 故答案为:Na3N+4H2O=3NaOH+NH3?H2O. |
相似问题
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为 下
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为,下列原子中,与氟元素原子的化学性质相似的是[
X Y两种元素的原子 当它们分别获得1个电子后 都能形成稀有气体的电子层结构 X放出的能量大于Y 则
X、Y两种元素的原子,当它们分别获得1个电子后,都能形成稀有气体的电子层结构,X放出的能量大于Y,则下列推断中不正确的是 [ ]A.原子序数X>YB.还原
下列各组表述中 两个微粒一定属于同种元素原子的是[ ]A.3p轨道有一个未成对电子的原子和核
下列各组表述中,两个微粒一定属于同种元素原子的是[ ]A.3p轨道有一个未成对电子的原子和核外电子排布式为1s22s22p63s23p1的原子 B.N层为4s2的原子和
已知A B C D E都是短周期元素 且原子序数依次增大 其中A和D的原子的最外层电子数都是各自电子
已知A、B、C、D、E都是短周期元素,且原子序数依次增大,其中A和D的原子的最外层电子数都是各自电子层数的2倍;B和C能组成C2B或C2B2型化合物;在C2B中C的
下列数字为几种元素的核电荷数 其中原子核最外层电子数最多的是[ ]A.8B.14 C.18D
下列数字为几种元素的核电荷数,其中原子核最外层电子数最多的是[ ]A.8B.14 C.18D.20












