在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中 发生反应。反应中各组分浓度随时间变
在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中,发生反应。反应中各组分浓度随时间变化关系如图。下列说法中,正确的是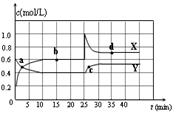
|
参考解答
| B |
| A、由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故A错误. B、X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol·L-1=0.4mol·L-1,所以υ(NO2)=0.4mol·L-1/10min =0.04mol·L-1·min-1,故 B正确; C、25min时,生产物浓度增大,反应物浓度不变,只能是增大生产物的浓度,由(2)分析可知NO2是生成物,故为增大NO2的浓度,故C错误; D、由图可知0-2.5min平衡状态时,X表示的生成物的浓度变化量为(0.5-0.2)mol·L-1=0.3mol·L-1,Y表示的反应物的浓度变化量为(0.6-0.5)mol·L-1=0.1mol·L-1,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的3倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,故D错误; |
相似问题
一定条件下 可逆反应N2 +3H22NH3 有关该反应的叙述正确的是( )A.正催化剂能加快正反
一定条件下,可逆反应N2 +3H22NH3,有关该反应的叙述正确的是()A.正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间B.将lmo
在一密闭容器中反应mA(g)nB(g)+nC(g)达到平衡。保持温度不变 将容器容积压缩到原来的一半
在一密闭容器中反应mA(g)nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1 8倍。则A.
反应2X(g)+Y(g)2Z(g) △H
反应2X(g)+Y(g)2Z(g) △H<0,在不同温度(T1和T2)及压强(P1和 P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示 下列判断正确的是A.T1
(10分)已知几种共价键的键能数据如下:共价键N≡NH-HN-H键能/(kJ·mol-1)94643
(10分)已知几种共价键的键能数据如下:共价键N≡NH-HN-H键能/(kJ·mol-1)946436390 8⑴通过计算,写出合成氨反应的热化学方程式。⑵某温度下,以1
一定条件下 某反应的化学方程式为:CO2+NO NO2+CO 下列说法正确的是( )A.升
一定条件下,某反应的化学方程式为:CO2+NO NO2+CO ,下列说法正确的是()A.升高温度,正反应速率增大,逆反应速率减少B.恒温时,压缩容器的体积












