有机物A由碳 氢 氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧 燃
| 有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题: (1)2.3g A中所含氢原子、碳原子的物质的量各是多少? (2)通过计算确定该有机物的分子式。 |
参考解答
(1)解:n(O2)=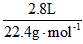 =0.125mol m(O2)=0.125 mol×32g·mol-1=4g =0.125mol m(O2)=0.125 mol×32g·mol-1=4g n(H2O)= 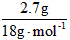 = 0.15mol n(CO2) = = 0.15mol n(CO2) =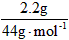 =0.05mol =0.05mol m(CO)=4g+2.3g-2.7g-2.2g=1.4g n(CO)= 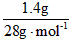 =0.05mol =0.05mol n(H)=2n(H2O)= 0.15mol×2=0.3mol;n(C)=n(CO2)+n(CO)=0.05mol+0.05mol=0.1mol (2)解:2.3g A中所含氧原子: n(O)=(0.05mol×2+0.05mol+0.15mol)-0.125mol×2=0.05mol n(C)∶n(H)∶n(O) =0.1mol∶0.3mol∶0.05mol=2∶6∶1 则A 的最简式为 C2H6O 根据价键规则 A的分子式为:C2H6O |
相似问题
(1)某芳香烃的分子式为C8H10 它的苯环上的一氯代物有3种。 ①该芳香烃两种可能的结构简式是__
(1)某芳香烃的分子式为C8H10,它的苯环上的一氯代物有3种。 ①该芳香烃两种可能的结构简式是_______________、_______________。②若使上述芳香烃与氯
一种气态烷烃和一种气态烯烃的混和物1体积 完全燃烧后能生成1.2体积的CO2(相同条件下) 则该混和
一种气态烷烃和一种气态烯烃的混和物1体积,完全燃烧后能生成1.2体积的CO2(相同条件下),则该混和物里一定含有[ ]A.CH4 B.C2H4C.C3H8D.C2H6
常温下将CH4与O2混合气体57mL点燃 CH4充分燃烧后恢复到原始状态 剩余气体为23mL 试计算
常温下将CH4与O2混合气体57mL点燃,CH4充分燃烧后恢复到原始状态,剩余气体为23mL,试计算原混合气体的组成。
将1.62g淀粉在一定条件下水解 反应一段时间后 向容器中加入足量的银氨溶液 结果析出0.108g银
将1 62g淀粉在一定条件下水解,反应一段时间后,向容器中加入足量的银氨溶液,结果析出0 108g银,则淀粉的水解率为 [ ]A.8%B.10%C.5% D.无法计算
有两种气态烃组成的混和气体 对氢气的相对密度为13 取此混和气体4.48L(标准状况下)通入足量溴水
有两种气态烃组成的混和气体,对氢气的相对密度为13,取此混和气体4 48L(标准状况下)通入足量溴水,溴水增重2 8g,则此混和气体的组成是[ ]A.CH4与C3












