将2.80 g CaO与500 mL某浓度的盐酸充分反应 将所得溶液平均分成两份。向其中一份中加入足
| 将2.80 g CaO与500 mL某浓度的盐酸充分反应,将所得溶液平均分成两份。向其中一份中加入足量的AgNO3溶液,生成的沉淀干燥后的质量为14.4 g;向另一份溶液中加入足量Zn粒,产生0.560 L(标准状况)气体。计算所用盐酸中HCl的物质的量浓度。 |
参考解答
| 0.400 mol·L-1 |
| CaO+2HCl====CaCl2+H2O Zn+2HCl====ZnCl2+H2↑ 由于Zn跟HCl反应放出H2,知CaO与盐酸反应中盐酸过量,CaO全部与HCl反应生成CaCl2,即所得溶液是CaCl2和HCl的混合液。 法一:守恒法 Ag++Cl-====AgCl↓ Cl-全部来自于盐酸中 c(HCl)=n(Cl-)=n(AgCl)×2= 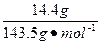 ×2≈0.200 mol ×2≈0.200 molc(HCl)= 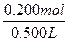 ='0.400' mol·L-1。 ='0.400' mol·L-1。法二:关系式(量)法 跟CaO反应的盐酸 n1(HCl)=2n(CaO)=2× 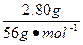 ='0.100' mol ='0.100' mol跟Zn反应的盐酸 n2(HCl)=2×2n(H2)=2×2× 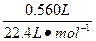 ='0.100' mol ='0.100' mol总盐酸量n(HCl)='0.200' mol c(HCl)= 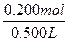 ='0.400' mol·L-1。 ='0.400' mol·L-1。 |
相似问题
下列物质间反应的离子方程式不正确的是( )A.Cl2通过FeBr2溶液中按1∶2物质的量的比反
下列物质间反应的离子方程式不正确的是( )A.Cl2通过FeBr2溶液中按1∶2物质的量的比反应:2Cl2+2Fe2++2Br-====4Cl-+2Fe3++Br2B.过量小苏打溶液与澄清石
(16分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe Al等杂质)制取CoCl
(16分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:已知:①钴与盐酸反应的化学方程
卤族元素随原子核电荷数的增加 下列叙述不正确的是()A.原子半径依次增大B.元素的非金属性依次减弱C
卤族元素随原子核电荷数的增加,下列叙述不正确的是()A.原子半径依次增大B.元素的非金属性依次减弱C.单质的氧化性依次减弱D.氢化物的稳定性依次增强
100mL 2mol/L的溴化钠溶液中通入一定量氯气后 将溶液蒸干得到固体16.15g。求(1)通入
100mL 2mol L的溴化钠溶液中通入一定量氯气后,将溶液蒸干得到固体16 15g。求(1)通入的氯气在标况下的体积是多少 ? (2)所得固体的成份及各自物质的量
氯水用于消毒是因为A.氯水中含有氯分子B.氯水中含有次氯酸分子C.氯水中含有氯离子D.氯水中含有氢离
氯水用于消毒是因为A.氯水中含有氯分子B.氯水中含有次氯酸分子C.氯水中含有氯离子D.氯水中含有氢离子












