氯化钾样品中含有少量碳酸钾 硫酸钾和不溶于水的杂质.为了提纯氯化钾 先将样品溶于适量水中 充分搅拌后
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作.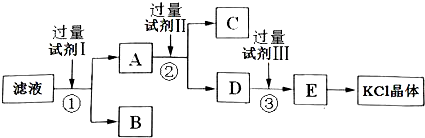 回答下列问题: (1)检验滤液中的SO42-的方法是 . (2)试剂I的化学式为 ,加入试剂I后,①对应的实验操作是 ,①中发生反应的离子方程式为 . (3)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 . (4)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 . (5)某同学称取提纯的产品0.745g,溶解后定容在100mL容量瓶中,每次取25.00mL溶液,与0.1000mol?L-1的硝酸银标准溶液反应,三次反应消耗硝酸银标准溶液的平均体积为23.50mL,该产品的纯度为 . |
参考解答
答案:(1)取少量滤液于试管中,向其中加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则有SO42-,反之则无;
(2)BaCl2;过滤;Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓;
(3)K2CO3;除去多余的Ba2+;
(4)盐酸;2H++CO32-=H2O+CO2↑;
(5)94%.
解析:(1)首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有2SO42-,反之则无,故答案为:取少量滤液于试管中,向其中加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则有SO42-,反之则无;
(2)要除掉杂质离子硫酸根和碳酸根,应加入过量的氯化钡溶液,碳酸根和硫酸根生成不溶于水的钡盐,同时生成氯化钾,离子方程式为:Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓,故答案为:BaCl2;过滤;Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓;
(3)要除掉多余的钡离子,要加入碳酸钾,碳酸钾和氯化钡反应生成碳酸钡沉淀同时生成氯化钾,离子方程式为
Ba2++CO32-=BaCO3↓,故答案为:K2CO3;除去多余的Ba2+;
(4)要除掉多余的碳酸根,要滴加适量的盐酸,碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为2H++CO32-=H2O+CO2↑,故答案为:盐酸;2H++CO32-=H2O+CO2↑;
(5)设25mL氯化钾溶液中氯化钾的物质的量为nmol.
KCl+AgNO3=AgCl+KNO3
1mol 1mol
nmol 0.1000mol·L-1 ×0.02350L
n=0.002350mol
100mL溶液中含有氯化钾的物质的量=0.002350mol×4=0.0094mol
100mL溶液中含有氯化钾的质量=0.0094mol×74.5g/mol=0.7003g
质量分数=0.7003g/0.745g×100%=94%,故答案为:94%.
相似问题
下列离子方程式中 正确的是( )A.氧化钠投入水中:O2-+H2O═2OH-B.在CuSO4溶液中
下列离子方程式中,正确的是( )A.氧化钠投入水中:O2-+H2O═2OH-B.在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2++SO42-═BaSO4↓C.氯气通入水中:Cl
写出下列离子方程式(1)等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液混合______.(2
写出下列离子方程式(1)等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液混合______.(2)硫酸铝溶液与过量Ba(OH)2溶液反应______.(3)三氯化铁浓溶液
下列离子方程式正确的是( )A.澄清的石灰水与盐酸反应 Ca(OH)2+2H+=Ca2++2H2
下列离子方程式正确的是( )A.澄清的石灰水与盐酸反应 Ca(OH)2+2H+=Ca2++2H2OB.Zn与醋酸反应 Zn+H+=Zn2++H2↑C.铜片插入硝酸银溶液Cu+Ag+=Cu2
在下列反应中 其离子方程式不能用H++OH-=H2O表示的是( )A.Ba(OH)2溶液与稀HNO
在下列反应中,其离子方程式不能用H++OH-=H2O表示的是( )A.Ba(OH)2溶液与稀HNO3B.Cu(OH)2与稀HNO3C.NaOH溶液与NaHSO4溶液D.KOH溶液与盐酸溶液
下列离子方程式书写正确的是( )A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++S
下列离子方程式书写正确的是( )A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-→BaSO4↓+H2OB.标准状况下将112mL氯气通入10mL1












