现有一种溶液 其中可能含有Mg2+ Al3+ Fe2+ Cu2+ NH4+.当加入一种淡黄色固体并加
| 现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+.当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.试回答下列问题: (1)最终的白色沉淀的成分是(填化学式)______,你的理由是______. (2)试确定该溶液中可能含有以上离子中的哪些离子并计算其相应的物质的量,完成下表
(4)图中b点的气体组成成分是(填化学式)______,其物质的量之比是______. 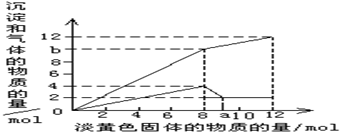 |
参考解答
| (1)淡黄色粉末是过氧化钠,溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过量的过氧化钠时,生成白色沉淀,推断一定有Mg2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁,故答案为:Mg(OH)2;氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱; (2)淡黄色粉末是过氧化钠,溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,由上式看出加入的量与生成量的比例,根据a-12mol这一段,所得氢氧化镁的物质的量是2mol,所以含有镁离子其物质的量为2mol,消耗氢氧化钠4mol,即在0-8mol这一段内,共生成沉淀4mol,所以另外2mol是氢氧化铝,即铝离子的物质的量为2mol,根据铵离子与氢氧化钠的氢氧根反应生成氨气,生成6mol的氨气,所以含有铵根离子是6mol,再之后是曲线了,这是因为铵离子几乎消耗完全,只剩下过氧化,与水反应生成氧气,而这反应会受温度,浓度等影响,因此会随着反应的反应,反应速率会变化,因此是曲线,故答案为:
(4)先把图象分两截看,0-8一段,8-a一段,之后一段,分析0-8这段图象,加入8mol过氧化钠,生成4mol氧气,图象中明显生成b=10mol气体,所以生成氨气是6mol,氨气和氧气的物质的量之比是3:2,故答案为:NH3、O2;3:2. |
相似问题
(1)用离子方程式表示下列应用或现象①小苏打与烧碱溶液的反应______②稀硫酸与氢氧化钡的反应__
(1)用离子方程式表示下列应用或现象①小苏打与烧碱溶液的反应______②稀硫酸与氢氧化钡的反应______(2)根据下列离子方程式,各写一个符合条件的化学
下列离子反应方程式正确的是( )A.硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓B.氢氧
下列离子反应方程式正确的是( )A.硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓B.氢氧化铜溶液和盐酸溶液反应:H++OH-=H2OC.锌粒溶于醋酸:Zn+2H+=Zn
下列离子方程式正确的是( )A.硝酸汞溶液和铝反应:Hg2++Al=Al3++HgB.氧化铜和硫酸
下列离子方程式正确的是( )A.硝酸汞溶液和铝反应:Hg2++Al=Al3++HgB.氧化铜和硫酸溶液反应:Cu2++2H+=Cu2++H2OC.锌和稀硫酸反应:Zn+2H+=Zn2++H2
已知电离平衡常数:K(H2CO3)>K(HClO)>K(HCO3-) 氧化性:HClO>Cl2>Br
已知电离平衡常数:K(H2CO3)>K(HClO)>K(HCO3-),氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中正确的是( )A.
化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语中 错误的是( )A.钢铁腐蚀时可能发
化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语中,错误的是( )A.钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-=4OH-B.表示H2燃烧












