[化学选修3:物质结构与性质]Q R X Y Z为周期表前四周期元素 原子序数依次递增.已知:①Q为
| [化学选修3:物质结构与性质] Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知: ①Q为元素周期表中原子半径最小的元素; ②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同; ③Y的基态原子的核外成对电子数是未成对电子数的3倍; ④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂; ⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同. 请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示) (1)化合物M的空间构型为______,其中心原子采取______杂化;化合物N在固态时的晶体类型为______. (2)R、X、Y三种元素的第一电离能由小到大的顺序为______; (3)由上述一种或多种元素组成的与RY2互为等电子体的分子为______(写分子式) (4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质.该反应的离子方程式为______. (5)Z原子基态时的外围电子排布式为______;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为______. 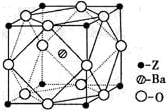 |
参考解答
| 由信息可知,Q为氢元素,R为碳元素,X为N元素,Y为氧元素,Z为钛元素,M为甲醛,N为苯; (1)化合物M为甲醛,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化,空间结构为平面三角形,化合物N为苯,是由碳、氢元素组成的化合物,苯是由苯分子直接构成的,则N在固态时的晶体类型为分子晶体,故答案为:平面三角形;sp2;分子晶体; (2)R、X、Y三种元素的分别为C、N、O,非金属性越强则元素的第一电离能越大,但N原子的电子排布中P轨道半满,则失去1个电子更难,即三种元素中N元素的第一电离能最大, 故答案为:C<O<N; (3)RY2为CO2,分子中有3个原子,价电子数为4+6×2=16,N2O的分子中有3个原子,价电子数为5×2+6=16,则CO2与N2O互为等电子体,故答案为:N2O; (4)由RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,由反应物与生成物,利用元素守恒、电荷守恒,则离子方程式为2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O, 故答案为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O; (5)因Z4+离子和氩原子的核外电子排布相同,则Z的原子序数为22,即Z为钛元素,其电子基态电子排布为1S22S22P63S23P63d24s2,电子最后填充3d电子,则外围电子排布为 3d24s2,由晶体结构图可知,晶体内与每个Z原子等距离且最近的氧原子在棱的位置,则氧原子数为
|
相似问题
下列叙述正确的是( )A.H++OH-=H2O表示所有强酸和强碱的反应B.所有的离子方程式都可以表
下列叙述正确的是( )A.H++OH-=H2O表示所有强酸和强碱的反应B.所有的离子方程式都可以表示一类反应C.单质和氧化物在离子方程式中不能用离子符号表
下列化学用语错误的是( )A.氢硫酸的电离方程式:H2S?2H++S2-B.明矾水解的离子方程式:
下列化学用语错误的是( )A.氢硫酸的电离方程式:H2S?2H++S2-B.明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+C.钢铁腐蚀时可能发生的正极电极反
下列电离方程式中 错误的是( )A.MgCl2═Mg2++2Cl-B.NaHSO4═Na++H++
下列电离方程式中,错误的是( )A.MgCl2═Mg2++2Cl-B.NaHSO4═Na++H++SO42-C.NaHCO3═Na++H++CO32-D.Ba(OH)2═Ba2++2OH-
有200mLMgCl2和AlCl3的混合溶液 其中Mg2+浓度为0.2mol?L-1 Cl-浓度为1
有200mLMgCl2和AlCl3的混合溶液,其中Mg2+浓度为0 2mol?L-1,Cl-浓度为1 3mol?L-1.要使Mg2+全部转化为沉淀分离出来,至少需加4mol?L-1NaOH溶液的体积为
下列反应的离子方程式 正确的是( )A.氯气通入水中Cl2+H2O=2H++Cl-+ClO-B.将
下列反应的离子方程式,正确的是( )A.氯气通入水中Cl2+H2O=2H++Cl-+ClO-B.将大理石投入稀盐酸CO32-+2H+=H2O+CO2↑C.在稀硫酸中加入Ba(OH)2溶液












