NaHSO4与NaHCO3是两种重要的酸式盐.(1)NaHSO4固体溶于水显酸性 而NaHCO3固体
| NaHSO4与NaHCO3是两种重要的酸式盐. (1)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并配以必要的文字说明表示NaHCO3固体溶于水显碱性的原因______ (2)常温下把l mL 0.2mol/L的NaHSO4溶液加水稀释成2L溶液,此时溶液中由水电离产生的c(H+)为______. (3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为______. (4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性,请写出发生的离子方程式______;在以上溶液中,继续滴加Ba(OH)2溶液,此时发生的离子方程式为______. (5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式为______. |
参考解答
| (1)NaHCO3为强碱弱酸盐,HCO3-离子既能水解又能发生电离,溶液呈碱性,说明水解程度大于电离程度, 故答案为:NaHCO3=Na++HCO3-、HCO3-+H2O 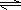 H2CO3+OH-;HCO3- 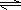 CO32-+H+,且HCO3-水解程度大于电离程度,故溶液呈碱性; (2)稀释后溶液中的H+离子浓度为
故答案为:1×10-10mol/L; (3)NaHSO4固体溶于水显酸性,与NaHCO3溶液反应产生二氧化碳和水,离子方程式为:H++HCO3-=H2O+CO2↑,故答案为:H++HCO3-=H2O+CO2↑; (4)设NaHSO4为2mol,加入Ba(OH)2溶液至呈中性时,需1molBa(OH)2,则反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,反应后SO42-离子过量,继续加Ba(OH)2溶液,此时发生的离子方程式为SO42-+Ba2+=BaSO4↓,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;SO42-+Ba2+=BaSO4↓; (5)设NaHCO3和Ba(OH)2都为1mol,分别发生反应:HCO3-+OH-=H2O+CO32-;CO32-+Ba2+-=BaCO3↓,总反应为:HCO3-+Ba2++OH-=BaCO3↓+H2O, 故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O. |
相似问题
在饱和碳酸钠溶液中通入足量的CO2 溶液中有浑浊出现 写出该反应的离子方程式______ 有上述现象
在饱和碳酸钠溶液中通入足量的CO2,溶液中有浑浊出现,写出该反应的离子方程式______,有上述现象发生的原因除了在相同温度下,NaHCO3溶解度小于Na2CO3以
下列离子方程式书写正确的是( )A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═C
下列离子方程式书写正确的是( )A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2OB.向次氯酸钡溶液中加入硫酸亚铁溶液:Ba2++SO42-═
下列用来表示物质变化的化学用语中 错误的是( )A.小苏打在水中的电离方程式:NaHCO3→Na+
下列用来表示物质变化的化学用语中,错误的是( )A.小苏打在水中的电离方程式:NaHCO3→Na++H++CO32-B.明矾水解的离子方程式:Al3++3H2OAl(OH)3+
下列离子方程式正确的是( )A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-B.碳酸钙中滴
下列离子方程式正确的是( )A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-B.碳酸钙中滴加硝酸:CO32-+2H+=CO2↑+H2OC.水玻璃溶液中滴入盐酸:SiO32-+2H+=H2
向20mL Na2SO4溶液中加过量的氯化钡溶液 得到2.33g沉淀 原溶液中Na+的物质的量浓度为
向20mLNa2SO4溶液中加过量的氯化钡溶液,得到2 33g沉淀,原溶液中Na+的物质的量浓度为( )A.1 0mol LB.2 0mol LC.0 50mol LD.0 025mol L












