黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼 煅烧后得到粗铜和炉渣 冶炼过程的主要反应
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有: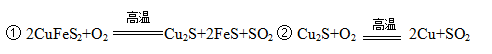 (1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。 (2)反应②中还原剂是 。 (3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。  ① 炉渣碱浸时反应的离子方程式是 、 。 ② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。 |
参考解答
| (1)-2 (2)Cu2S (3)①SiO2+2OH-=SiO32-+H2O Al2O3+2OH-=2AlO2-+H2O ②4FeO+O2+12H+=4Fe3++6H2O 再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。 |
| (1)二硫化亚铁铜也可以表示为CuS。FeS,其中硫元素的化合价是-2价; (2)反应②中Cu2S中Cu元素的化合价由+1价升高到+2价,硫元素的化合价由-2价升高到+4价,被氧化,做还原剂; (3)①炉渣中加入过量氢氧化钠溶液发生的离子方程式是SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;②滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是,4FeO+O2+12H+=4Fe3++6H2O;为检验铁元素是否被完全氧化,可难舍难分滤液中是否含有Fe2+,应进行的实验操作是,取少量滤液2于试管中,再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。 |
相似问题
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-
在0 1 mol L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式
下列离子反应方程式正确的是( )A.氨水吸收过量的SO2:OH-+SO2=HSO3-B.FeS
下列离子反应方程式正确的是( )A.氨水吸收过量的SO2:OH-+SO2=HSO3-B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH-C.NaAlO2溶液中加入
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中 产生沉淀的质量与加入X的物质的量关系如下图 符
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图,符合图中情况的一组物质是(A)(B)(C)(D)XBa(
下列相关反应的离子方程式书写正确的是A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2
下列相关反应的离子方程式书写正确的是A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2OB.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+C.向碳酸氢
古诗词是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的是 [ ]A.野火烧不尽
古诗词是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的是 [ ]A.野火烧不尽,春分吹又生B.爆竹声中一岁除,春风送暖入屠苏C.春蚕到












