向20mL5mol/L的AlCl3溶液中滴入2.5mol/LNaOH溶液时 得到沉淀的质量与所滴加N
| 向20mL5mol/L的AlCl3溶液中滴入2.5mol/LNaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系: (1)图中a点表示的意义是______.图中b点表示的意义是______. (2)写出滴入NaOH溶液至b点整个过程反应的离子方程式:______. (3)若溶液中产生沉淀3.9g,则消耗NaOH溶液的体积可能为______. 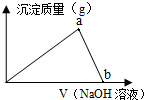 |
参考解答
| (1)根据图示可知,图中随着加入氢氧化钠溶液逐渐增多,生成的氢氧化铝沉淀质量逐渐增大,到达a点时沉淀达到最大;从a点之后,生成的氢氧化铝沉淀逐渐溶解,在图中b点氢氧化铝完全溶解, 故答案为:Al3+完全沉淀;Al(OH)3刚好完全溶解; (2)把NaOH溶液滴入AlCl3溶液中,先产生Al(OH)3沉淀,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,到达a点后氢氧化铝逐渐溶解,反应的离子方程式为:Al(OH)3+OH-=AlO2-+H2O, 故答案为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+H2O; (3)3.9g氢氧化铝的物质的量为:
①AlCl3过量,加入NaOH使Al3+部分产生沉淀3.9 g,根据反应Al3++3OH-=Al(OH)3↓可知消耗氢氧化钠的物质的量为:0.05×3=0.15mol,需要氢氧化钠溶液的体积为:
②当NaOH过量使Al3+全部参加反应生成Al(OH)3沉淀后又部分溶解,根据反应Al3++3OH-=Al(OH)3↓,氯化铝离子完全生成氢氧化铝需要氢氧化钠溶液的体积为:
故答案为:60 mL或140mL. |
相似问题
下列离子方程式的书写正确的是( )A.硅和浓氢氧化钠溶液反应:2Si+6OH-=2SiO32-+3
下列离子方程式的书写正确的是( )A.硅和浓氢氧化钠溶液反应:2Si+6OH-=2SiO32-+3H2↑B.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑C.向氯化铝溶液中加
下列离子方程式中 正确的是( )A.碳酸氢钠与硫酸氢钠反应:+====+H2O+CO2↑B.硫酸
下列离子方程式中,正确的是()A.碳酸氢钠与硫酸氢钠反应:+====+H2O+CO2↑B.硫酸与氢氧化钡反应:H+++Ba2++OH-====BaSO4↓+H2OC.锌和稀硫酸反应:Zn
下列反应的离子方程式书写正确的是A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑B
下列反应的离子方程式书写正确的是A.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑B.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O C.用小苏
下列离子方程式不正确的是A.苯酚钠溶液与二氧化碳反应: 2C6H5O-+ CO2 + H2O = 2
下列离子方程式不正确的是A.苯酚钠溶液与二氧化碳反应: 2C6H5O-+ CO2 + H2O = 2C6H5OH + CO32-B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶
下列化学反应的离子方程式正确的是( )A.CO2通入Na2CO3溶液中:CO32-+CO2+H2O
下列化学反应的离子方程式正确的是( )A.CO2通入Na2CO3溶液中:CO32-+CO2+H2O=2HCO3-B.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+C.将氯气溶于水中












