铁 铝是现代金属材料的主角.(1)写出Al的原子结构示意图______;稀硝酸溶液中加入过量铁粉发生
| 铁、铝是现代金属材料的主角. (1)写出Al的原子结构示意图______;稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为______; (2)已知:铝的燃烧热为1675kJ?mol-1;2Fe(s)+3/2O2(g)═Fe2O3(s);△H=-822kJ?mol-1;则2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s);△H=______; (3)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于______处(填“M”或“N”).若X为锌,开关K置于M处,则此时铁棒上发生的电极反应方程式为______; (4)对金属制品进行抗腐蚀处理,可延长其使用寿命.铁制品表面镀铜可防止其腐蚀,电镀时为了补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定,则阳极材料必须为______. 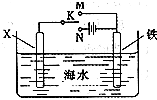 |
参考解答
(1)根据原子核外电子排布的规律知13号铝原子结构示意图为: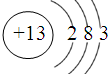 ,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为:  ;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O; (2)结合铝的燃烧热含义,可得4Al(s)+3O2(g)═2Al2O3(S)△H=-4×1675kJ?mol-1=-6700kJ?mol-1,根据盖斯定律,反应2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)的△H=-0.5×1675kJ?mol-1+822kJ?mol-1=-2528KJ/mol,故答案为:-2528KJ/mol; (3)在电解池中金属作为阴极可以起到保护作用,故为减缓铁的腐蚀,开关K应该置于N处,若X为锌,开关K置于M处,则此时为原电池装置,铁棒为正极,锌为负极,锌发生吸氧腐蚀,铁电极反应方程式为:O2+4e-+2H2O═4OH-,故答案为:N;O2+4e-+2H2O═4OH-; (4)根据电镀的原理和电镀装置的特点,阳极必须为镀层金属,故答案为:Cu. |
相似问题
下列离子方程式正确的是( )A.Fe3++Fe=2Fe2+B.2Fe3++3Cu=2Fe+3Cu2
下列离子方程式正确的是( )A.Fe3++Fe=2Fe2+B.2Fe3++3Cu=2Fe+3Cu2+C.Fe2++2H++H2O2=Fe3++2H2OD.2Fe2++Cl2=2Fe3++2Cl-
下列离子方程式正确的是( )A.碳酸钙与稀HNO3:CO32-+2H+=CO2↑+H2OB.Cu与
下列离子方程式正确的是( )A.碳酸钙与稀HNO3:CO32-+2H+=CO2↑+H2OB.Cu与AgNO3溶液:Cu+2Ag+=Cu2++2AgC.Fe与稀H2SO4:2Fe+6H+=2Fe3++3H2↑D.Ba(OH)2与稀H2SO4:Ba2++SO42-=BaSO4↓
如图是某“泡腾片”的标签.将这样一粒泡腾片放入水中 药片完全溶解 同时产生了大量气泡.这个过程(
如图是某“泡腾片”的标签.将这样一粒泡腾片放入水中,药片完全溶解,同时产生了大量气泡.这个过程( ) 泡腾片每片含:碳酸钙 500mg维生素 1000
能正确表示下列化学反应的离子方程式的是( )A.铁跟醋酸溶液反应:Fe+2H+═Fe2++H2↑B
能正确表示下列化学反应的离子方程式的是( )A.铁跟醋酸溶液反应:Fe+2H+═Fe2++H2↑B.澄清石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2OC.铜片插
下列离子方程式不正确的是( )A.氢氧化钾溶液与盐酸反应:OH-+H+═H2OB.盐酸滴在石灰石上
下列离子方程式不正确的是( )A.氢氧化钾溶液与盐酸反应:OH-+H+═H2OB.盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑C.氢氧化钡溶液与硫酸铜溶液












