向FeI2溶液中不断通入Cl2 溶液中I- I2 Fe2+ Fe3+等粒子的物质的量随n(Cl2)
向FeI2溶液中不断通入Cl2,溶液中I-、I2、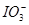 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。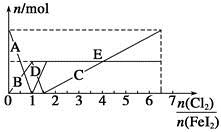 已知:2Fe3++2I-=I2+2Fe2+。 请回答下列问题: (1)指出图中折线E和线段C所表示的意义:折线E表示 ;线段C表示 。 (2)写出线段D所表示的反应的离子方程式: 。 (3)当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n( 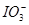 )= 。 )= 。 |
参考解答
| (1)n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况 n( 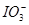 )随n(Cl2)∶n(FeI2)变化的情况 )随n(Cl2)∶n(FeI2)变化的情况(2)Cl2+2Fe2+=2Fe3++2Cl- (3)6.5 |
(1)有关物质的还原性顺序为I->Fe2+>I2,则向FeI2溶液中不断通入Cl2的过程中,依次发生的氧化还原反应为Cl2+2I-=2Cl-+I2,Cl2+2Fe2+=2Fe3++2Cl-,5Cl2+I2+6H2O=2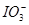 +12H++10Cl-。可见,当n(Cl2)∶n(FeI2)=1时,I-恰好全部被氧化;当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化;当n(Cl2)∶n(FeI2)=6.5时,氧化还原反应发生完毕。因此,当n(Cl2)∶n(FeI2)>1时,开始生成Fe3+,至n(Cl2)∶n(FeI2)=1.5时,n(Fe3+)达到最大值,故折线E代表了n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况;当n(Cl2)∶n(FeI2)>1.5时,开始生成 +12H++10Cl-。可见,当n(Cl2)∶n(FeI2)=1时,I-恰好全部被氧化;当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化;当n(Cl2)∶n(FeI2)=6.5时,氧化还原反应发生完毕。因此,当n(Cl2)∶n(FeI2)>1时,开始生成Fe3+,至n(Cl2)∶n(FeI2)=1.5时,n(Fe3+)达到最大值,故折线E代表了n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况;当n(Cl2)∶n(FeI2)>1.5时,开始生成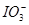 ,至n(Cl2)∶n(FeI2)=6.5时,n( ,至n(Cl2)∶n(FeI2)=6.5时,n(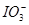 )达到最大值,故线段C代表了n( )达到最大值,故线段C代表了n(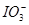 )随n(Cl2)∶n(FeI2)变化的情况。 )随n(Cl2)∶n(FeI2)变化的情况。(2)当n(Cl2)∶n(FeI2)>1∶1时,Fe2+开始被氧化,当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化,故线段D代表了n(Fe2+)随n(Cl2)∶n(FeI2)变化的情况。线段D所发生反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-。 (3)当n(Cl2)∶n(FeI2)=6.5时,根据元素守恒,可知溶液中n(Cl-)∶n( 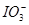 )=6.5。 )=6.5。 |
相似问题
已知:①向KMnO4晶体滴加浓盐酸 产生黄绿色气体; ②向FeCl2溶液中通入少量实验①产生的气体
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体; ②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色; ③取实验②生成的溶液滴在淀粉KI试纸上,
现有七种物质PbO2 MnSO4 Pb(NO3)2 PbSO4 HNO3 HMnO4 H2O组成一个
现有七种物质PbO2、MnSO4、Pb(NO3)2、PbSO4、HNO3、HMnO4、H2O组成一个化学方程式,已知PbO2等三种物质为反应物,PbSO4难溶于水。下列判断正确的是 [ ]
在2H2S+SO2==3S+2H2O中 氧化产物与还原产物的分子数之比是[ ]A. 1:2
在2H2S+SO2==3S+2H2O中,氧化产物与还原产物的分子数之比是[ ]A 1:2 B 2:1 C 3:1 D 3:2
氯酸是一种强酸 浓度超过40%时会发生分解 该反应可表示为aHClO3―→bO2↑+cCl2↑+dH
氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3―→bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是( )A.由反应可确定氧化性
常温下 往5%的H2O2溶液中滴加2~3滴FeCl3溶液 可发生如下两个反应:①2Fe3++H2O2
常温下,往5%的H2O2溶液中滴加2~3滴FeCl3溶液,可发生如下两个反应:①2Fe3++H2O2=2Fe2++O2↑+2H+ ②2Fe2++H2O2+2H+=2Fe3++2H2O 下列说法不正确的是












