已知 Fe2+结合S2-的能力大于结合OH-的能力 而Al3+则正好相反.在Fe2(SO4)3和Al
已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
|
参考解答
| 在Fe2(SO4)3和AlCl3溶液中加过量KI,先是Fe2(SO4)3与KI两盐发生氧化还原反应:2Fe3++2I-=2Fe2++I2,反应完后溶液中含大量Fe2+、Al3+、I2, 再加入Na2S后,由于S2-+H2O 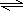 HS-+OH-.在Na2S溶液中,有大量S2-、OH-,依题意知,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀, Fe2++S2-=FeS↓;Al3+结合OH-能力强,形成Al(OH)3沉淀,Al3++3OH-=Al(OH)3↓,或理解为Al3+与S2-发生双水解反应:3Na2S+AlCl3+6H2O=2Al(OH)3↓+3H2S↑+6NaCl; 但由于I2的存在发生:I2+S2-=S↓+2I-或I2+H2S=S↓+2HI,所以最终得到的沉淀是FeS、Al(OH)3和S的混合物. 故选D. |
相似问题
下列叙述正确的是( )A.发生化学反应时失去电子越多的金属原子 还原能力越强B.金属阳离子被还原后
下列叙述正确的是( )A.发生化学反应时失去电子越多的金属原子,还原能力越强B.金属阳离子被还原后,一定得到该元素的单质C.核外电子总数相同的原
下列反应中 水既不是氧化剂又不是还原剂的氧化还原反应是( )A.Na2O和H2OB.Na和H2OC
下列反应中,水既不是氧化剂又不是还原剂的氧化还原反应是( )A.Na2O和H2OB.Na和H2OC.电解水D.Na2O2和H2O
氧化还原反应与四种基本类型反应的关系如图所示 则下列化学反应属于区域3的是( )A.2H2+O2
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )A.2H2+O2点燃 2H2OB.CuO+CO△ Cu+CO2C.2NaHCO3△ Na2CO3+H2O+CO2↑D.Zn+H2SO4=ZnSO4+H2↑
下列变化过程中 必需加入氧化剂才能实现的是( )A.Na2O2→NaOHB.CO2→COC.Fe2
下列变化过程中,必需加入氧化剂才能实现的是( )A.Na2O2→NaOHB.CO2→COC.Fe2+→Fe3+D.Ba(OH)2→BaSO4
下列反应都有水参加 其中属于氧化还原反应 而水既不做氧化剂 又不做还原剂的是( )A.2F2+2H
下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )A.2F2+2H2O=4HF+O2↑B.2Na+2H2O=2NaOH+H2↑C.C12+H2O=HC1O+HC1D.C+H2O高温 CO+H2












