已知:还原性HSO-3>I- 氧化性IO-3>I2.在含3mol NaHSO3的溶液中逐滴加入KIO
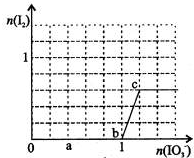
已知:还原性HSO-3>I-,氧化性IO-3>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如右图所示.下列有关说法正确的是( )
 |
参考解答
| 还原性HSO-3>I-,所以首先是发生以下反应离子方程式:2IO3-+6HSO3-═2I-+6SO42-+6H+,继续加入KIO3,已知氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,根据发生的反应,则: A、根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的KIO3的物质的量为
B、a点时加入的KIO3物质的量为0.4mol,根据反应方程式2IO3-+6HSO3-═2I-+6SO42-+6H+,消耗的NaHSO3的物质的量为1.2mol,剩余的NaHSO3的物质的量为1.8mol,故B错误; C、b点时加入的KIO3物质的量为1mol,和3mol NaHSO3的溶液恰好完全反应,不会生成碘单质,故C错误; D、NaHSO3中的HSO3-被氧化的最终产物是SO42-,不会出现三氧化硫,故D错误. 故选A. |
相似问题
火药是中国的四大发明之一 黑火药发生爆炸时的反应如下:2KNO3+3C+S═N2+K2S+3CO2
火药是中国的四大发明之一,黑火药发生爆炸时的反应如下:2KNO3+3C+S═N2+K2S+3CO2,用双线桥分析该反应并指出氧化剂和还原剂.
(1)在下列反应中 用序号填空:A.2F2+2H2O=4HF+O2 B.2Na+2H2O=
(1)在下列反应中,用序号填空:A.2F2+2H2O=4HF+O2B.2Na+2H2O=2NaOH+H2↑C.CaO+H2O=Ca(OH)2D.2H2O电解 2H2↑+O2↑水只作氧化剂的是______,水只作
传统的自来水消毒常采用漂白粉等强氧化剂 但其产生的有机氯对人体有一定的危害.一种新型的消毒剂--高铁
传统的自来水消毒常采用漂白粉等强氧化剂,但其产生的有机氯对人体有一定的危害.一种新型的消毒剂--高铁酸盐(如Na2FeO4或K2FeO4)能有效地杀灭水中的细
下列各组离子在碱性条件下能大量共存 且在强酸性条件下能发生氧化还原反应的是( )A.Ca2+ Al
下列各组离子在碱性条件下能大量共存,且在强酸性条件下能发生氧化还原反应的是( )A.Ca2+、Al3+、SO42-、Cl-B.K+、Na+、SO32-、NO3-C.Na+、K+、N
在NO2被水吸收的反应中 发生还原反应和发生氧化反应的物质 其质量比为______.
在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为______.












