硝酸工业生产中的尾气(主要成分为NO2和NO)可用纯碱溶液吸收 有关的化学反应为:2NO2+Na2C
| 硝酸工业生产中的尾气(主要成分为NO2和NO)可用纯碱溶液吸收,有关的化学反应为: 2NO2+Na2CO3=NaNO2+NaNO3+CO2↑① NO+NO2+Na2CO3=2NaNO2+CO2↑② (1)用双线桥法表示出反应①中电子转移的方向和数目2NO2+Na2CO3=NaNO2+NaNO3+CO2↑. (2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3?10H2O多少克? (3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.计算吸收液中NaNO2和NaNO3的物质的量之比.(写出计算过程) |
参考解答
(1)反应①中电子转移的方向和数目,用双线桥法表示为: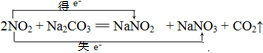 , ,答:用双线桥法表示出反应①中电子转移的方向和数目为  ; ;(2)配制1000g质量分数为21.2%的纯碱吸收液,溶液中溶质碳酸钠物质的量=
所以m(Na2CO3?10H2O)=2mol×286g/mol=572g, 答:需Na2CO3?10H2O为572g; (3)1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g. ①2NO2+Na2CO3=NaNO2+NaNO3+CO2↑△m=48g NO+NO2+Na2CO3=2NaNO2+CO2↑△m=32g 设由NO2与纯碱反应产生的CO2为amol, 由NO和NO2与纯碱反应产生的CO2为bmol,列方程计算 a+b=1 48a+32b=44 a=0.75mol b=0.25mol n(NaNO2):n(NaNO3)=5:3, 答:吸收液中NaNO2和NaNO3的物质的量之比为5:3. |
相似问题
下列变化中 需要加入氧化剂的是( )A.SO2→SO3B.HCl→H2C.FeCl3→FeCl2D
下列变化中,需要加入氧化剂的是( )A.SO2→SO3B.HCl→H2C.FeCl3→FeCl2D.Fe2O3→Fe
已知KClO3+6HCl=KCl+3Cl2↑+3H2O 下列说法不正确的是( )A.KClO3是氧
已知KClO3+6HCl=KCl+3Cl2↑+3H2O,下列说法不正确的是( )A.KClO3是氧化剂B.3molCl2生成时有5mol电子转移C.KCl是还原产物,Cl2是氧化产物D.被氧
下列反应中.属于氧化还原反应 但水既不作氧化剂也不作还原剂的是( )A.Cl2+H2O?HCl+H
下列反应中.属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )A.Cl2+H2O?HCl+HClOB.SO2+H2O?H2SO3C.3Fe+4H2O(g)=Fe3O4+4H2D.2Na+2H2O=2NaOH+H2↑
下列粒子不具有氧化性的是( )A.KB.Fe3+C.Cu2+D.Fe2+
下列粒子不具有氧化性的是( )A.KB.Fe3+C.Cu2+D.Fe2+
下列反应H2O中只作氧化剂的是( )A.2Na+2H2O=2NaOH+H2↑B.2F2+2H2O=
下列反应H2O中只作氧化剂的是( )A.2Na+2H2O=2NaOH+H2↑B.2F2+2H2O=4HF+O2C.Na2O+H2O=2NaOHD.2H2O电解 2H2↑+O2↑












