已知:还原性HSO3¯>I¯ 氧化性IO3¯> I2。在含3 mol
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列不正确的是( )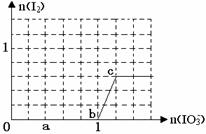
|
参考解答
| CD |
试题分析:根据还原性HSO3¯>I¯,氧化性IO3¯> I2,o~b, IO3 ̄氧化HSO3-生成I ̄、SO42 ̄、H+,离子方程式为:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+,故A项正确;a点n(IO3 ̄)=0.4mol,根据离子方程式可得:n(NaHSO4)=3n(IO3 ̄)=3×0.4mol=1.2mol,B项正确;b~c段,IO3 ̄氧化I ̄生成I2,IO3 ̄+5I ̄+6H+=3I2+3H2O,I2既是氧化产物也是还原产物,故C项不正确;氧化HSO3 ̄需要KIO3:1/3×3mol=1mol,生成I ̄1mol,设氧化I ̄的IO3 ̄为nmol,根据离子方程式可得氧化I ̄的物质的量为5n mol,生成的I2物质的量为3n mol,则(1-5n):3n=5:2,得n=0.08mol,所以加入的KIO3共1.08mol,D项不正确。 |
相似问题
下列反应中 氧化剂与还原剂的物质的量之比为2 :1 的是( )A.Cu +2 H2SO4(浓)
下列反应中,氧化剂与还原剂的物质的量之比为2 :1 的是()A.Cu +2 H2SO4(浓) = CuSO4 + SO2↑+ 2H2OB.2Na + H2SO4 = Na2 SO4 + H2↑C.3S + 6NaOH = 2Na2S + Na2SO3 + 3H2OD.2Na + Cl2 = 2NaCl
臭氧可使湿润的淀粉KI试纸变蓝 化学方程式为2KI+O3+H2O=2KOH+I2+O2。下
臭氧可使湿润的淀粉­KI试纸变蓝,化学方程式为2KI+O3+H2O=2KOH+I2+O2。下列叙述中正确的是( )A.在反应中水被氧化成氧气B.该反应中水是氧化剂C
24mL浓度为0.05mol·L-1 Na2SO3溶液恰好与20mL 浓度为0.02mol·L-1的
24mL浓度为0 05mol·L-1 Na2SO3溶液恰好与20mL 浓度为0 02mol·L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化
已知在酸性溶液中 下列物质氧化KI时 自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+ ;
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+ ;IO3-→I2;HNO3→NO如果分别用等物质的量的这些物质氧化足量的KI
有关反应5Cu + 4H2SO4(浓) Cu2S + 3CuSO4 + 4H2O的叙述正确的是A.氧
有关反应5Cu + 4H2SO4(浓) Cu2S + 3CuSO4 + 4H2O的叙述正确的是A.氧化剂与还原剂的物质的量之比为1:5B.每有1 mol Cu参加反应时转移2 mol












