高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:(1)已知:②锰有多种化
| 高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题: (1)已知: 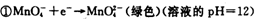 ② 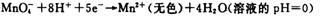 锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为 (填化学式)。 (2)查阅相关资料:发生如下反应(反应未配平): 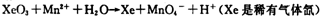 已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为 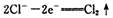 如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是 。 (3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。 写出该反应的离子方程式 。 (4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。 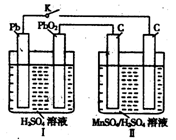 |
参考解答
| (14分,每空2分)(1)MnO2 (2)无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体) (3)2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O (4)Mn2+-2e-+2H2O=MnO2+4H+ Pb+PbO2+2H2SO4=2PbSO4+2H2O 2mol 87 |
试题分析:(1)根据反应①②可知,在碱性溶液中MnO4-被还原生成物是MnO42-,在酸性溶液中MnO4-被还原生成物是Mn2+,即溶液的酸性越强,还原产物中Mn的化合价越低,所以在中性溶液中,MnO4-被还原生成物是MnO2。 (2)根据已知反应可知,XeO3能把Mn2+氧化生成MnO4-。又因为氯离子的还原性强于Mn2+的还原性,所以反应中还有氯气生成,因此可能观察到的现象是无色溶液变为紫(或紫红)色,并产生气体(黄绿色气体)。 (3)草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去,这说明草酸具有还原性,能被酸性高锰酸钾溶液氧化生成CO2,所以反应的离子方程式是2MnO4-+5HC2O4+6H+=10CO2↑+2Mn2++8H2O。 (4)电解池中阳极失去电子,发生氧化反应,则Mn2+在阳极失去电子,发生氧化反应,因此阳极电极反应式是Mn2+-2e-+2H2O=MnO2+4H+。铅蓄电池中负极是Pb,正极是PbO2,所以铅蓄电池的总反应方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。所以根据方程式可知,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为2mol。根据电子得失守恒可知,阳极生成1mol MnO2,质量是87g。 |
相似问题
NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑ 下列有关说法正确的是A.NaH中H的化
NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,下列有关说法正确的是A.NaH中H的化合价为+1价,是氧化剂B.在该反应中H2O 为还原剂C.在该反应中NaH
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路 发生反应的化学方程式为: ①取少量废液 滴加K
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液
某化学反应的反应物和产物如下:Al+NaNO3+H2OAl(OH)3+N2+NaAlO2(1)该反应
某化学反应的反应物和产物如下:Al+NaNO3+H2OAl(OH)3+N2+NaAlO2(1)该反应的氧化剂是______________。(2)该反应的氧化产物是_______________。(3
(8分)中华民族在世界冶金史上曾谱写过辉煌的篇章 早在两千多年前的西汉时期就有“曾青得铁则化为铜”的
(8分)中华民族在世界冶金史上曾谱写过辉煌的篇章,早在两千多年前的西汉时期就有“曾青得铁则化为铜”的记载,这种方法是现代湿法冶金的先驱.硫酸铜溶
实验室可以用高锰酸钾和浓盐酸反应制取氯气 反应的化学方程式如下:2KMnO4 + 16HCl(浓)=
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4 + 16HCl(浓)="=" 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O。下列叙述错误












