实验室里迅速制备少量氯气可利用以下反应: KMnO4+ HCl KCl +
| 实验室里迅速制备少量氯气可利用以下反应: KMnO4+ HCl  KCl + MnCl2 + Cl2↑ + H2O KCl + MnCl2 + Cl2↑ + H2O (1)请配平上述化学方程式,并在上面用“双线桥法” 标明电子转移的方向和数目: (2)该反应的氧化产物是 ,KMnO4发生 反应。 (3)HCl在上述反应中显示出来的性质是 。
|
参考解答
| (1)2 KMnO4+16 HCl =' 2' KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O (2)Cl2、还原 (3)BC (4) 0.05 mol 1.58g 0.05NA或3.01×1022 |
试题分析:(1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8 H2O,用“双线桥法”标明电子转移的方向和数目为: 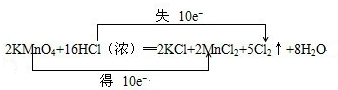 ; ;(2)反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,Cl2是氧化产物;反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4是氧化剂,发生还原反应; (3)由方程式可知,反应后KCl、Cl2中含有氯元素,KCl中氯元素化合价为-1价,Cl2中氯元素化合价为0价,说明反应中HCl表现酸性、还原性,选BC; (4)标准状况下560mlCl2的物质的量为0.025mol,被氧化的HCl生成Cl2,根据氯元素守恒可知被氧化的HCl为0.025mol×2=0.05mol;根据2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8 H2O可知,生成0.025molCl2,需要KMnO4的物质的量为0.01mol,质量为0.01mol×158g/mol=1.58g;反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,故转移电子物质的量为0.025mol×2=0.05mol,转移电子数目为0.05mol×NAmol-1=0.05NA。 |
相似问题
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOC12在酸性条件下可以产生C12
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOC1­2在酸性条件下可以产生C12,下列关于混盐CaOC12的有关判断不正确的是A.该混盐与硫酸反应产
锰酸钾可用于油脂 纤维 皮革的漂白等 其可由KOH KClO3和MnO2经共熔制备 反应原理为6KO
锰酸钾可用于油脂、纤维、皮革的漂白等,其可由KOH、KClO3和MnO2经共熔制备,反应原理为6KOH+KClO3+3MnO2KCl+3K2MnO4+3H2O。下列有关说法中正确的是
火药是中国的“四大发明”之一 永远值得炎黄子孙骄傲 也永远会激励着我们去奋 发图强。黑火药在发生爆炸
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋 发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+
向盛有KI溶液的试管中加入少许CC14后滴加氯水 CCl4层变成紫色。如果继续向试管中滴加氯水 振荡
向盛有KI溶液的试管中加入少许CC14后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CC14层会逐渐变浅,最后变成无色。完成下列填空:(1)上
根据表中信息判断 下列选项不正确的是序号反应物产物①KMnO4 H2O2 H2SO4K2SO4 Mn
根据表中信息判断,下列选项不正确的是序号反应物产物①KMnO4、H2O2、H2SO4K2SO4、MnSO4…②Cl2、FeBr2FeCl3、FeBr3③MnO4-…Cl2、Mn2+…A.第①组反应












