某学生两次分别用2.6 g锌与硝酸溶液进行反应 两次所用的硝酸溶液中均含有6.3 g的HNO3 但浓
| 某学生两次分别用2.6 g锌与硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g的HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的反应方程式___________________________ _______________________________________________________________________________。 |
参考解答
| 4Zn+10HNO3====4Zn(NO3)2+N2O↑+5H2O 4Zn+10HNO3====4Zn(NO3)2+NH4NO3+3H2O |
| 2.6 g Zn为0.04 mol,6.3 g HNO3为0.1 mol。第一次实验: 0.04 mol×2= 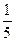 ×0.1 mol×(5-n) ×0.1 mol×(5-n)n=+1,即生成物为N2O。 第二次实验: 0.04 mol×2= 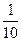 ×0.1 mol×(5-n) ×0.1 mol×(5-n)n=-3,即还原产物为NH4NO3。 |
相似问题
下列关于氧化还原反应的叙述 正确的是[ ]A.失去电子的反应是还原反应 B.失去电子的物质
下列关于氧化还原反应的叙述,正确的是[ ]A.失去电子的反应是还原反应 B.失去电子的物质是还原剂 C.发生氧化反应的物质是氧化剂 D.作氧化剂的物
在下列反应中 化学式下面画有短线的物质只作氧化剂的是( )A.2NH3+3Cl2====N2+
在下列反应中,化学式下面画有短线的物质只作氧化剂的是( )A.2NH3+3Cl2====N2+6HClB.2NH3+3CuON2+3Cu+3H2OC.Cl2+2NaOH====NaCl+NaClO+H2OD.KClO3+6HCl(浓) ====KCl+3Cl2↑+3H2O
下列反应中 不属于氧化还原反应的是A.锌和硫酸反应: Zn+H2SO4= ZnSO4 + H2B.碳
下列反应中,不属于氧化还原反应的是A.锌和硫酸反应: Zn+H2SO4= ZnSO4 + H2B.碳酸钙和盐酸反应: CaCO3+2HCl = CaCl2 + CO2 + H2OC.过氧
(8分)根据Cu+2HSO(浓)CuSO+SO↑+2HO完成以下问题(已知Cu的相对原子质量为64)
(8分)根据Cu+2HSO(浓)CuSO+SO↑+2HO完成以下问题(已知Cu的相对原子质量为64):(1)该反应中氧化剂是____________,被氧化的元素是______________
在5NH4NO32HNO3+4N2+9H2O反应中 发生氧化反应的氮原子与发生还原反应的氮原子的物质
在5NH4NO32HNO3+4N2+9H2O反应中,发生氧化反应的氮原子与发生还原反应的氮原子的物质的量之比是()A.5∶8B.5∶4C.5∶3D.3∶5












