(1)维生素C 又称“抗坏血酸” 在人体内有重要的功能.例如 能帮助人体将食物中摄取的不易吸收的Fe
| (1)维生素C 又称“抗坏血酸”,在人体内有重要的功能.例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的 Fe2+,这说明维生素C 具有______性.(填氧化性或还原性) (2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2K NO3+3C =K2S+N2↑+3CO2↑.该反应的氧化剂是______,当16g 硫参加反应时,转移的电子总数为______. (3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O.上述反应中,若有10个铝原子参与反应,则转移的电子数为______个,用“双线桥法”标明反应中电子转移的方向和数目. |
参考解答
| (1)维生素C能Fe3+转变为易吸收的Fe2+,反应中铁离子得电子作氧化剂,则维生素C作还原剂,还原剂具有还原性,所以维生素C具有还原性,故答案为:还原性; (2)反应S+2K NO3+3C=K2S+N2↑+3CO2↑中,硫元素化合价由0→-2价,N元素由+5价→0价,所以硫和硝酸钾得电子化合价降低作氧化剂, S+2K NO3+3C=K2S+N2↑+3CO2↑ 转移电子 32g 12N A 16g 6NA 所以转移电子数是6NA, 故答案为:S、KNO3,6NA; (3)根据铝和转移电子之间的关系式计算转移电子数,根据元素化合价变化标出反应中电子转移的方向和数目. 10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O转移电子 10 30 10 30 所以若有10个铝原子参与反应,则转移的电子数为30, 该反应中铝失去电子数为10×3,NaNO3得到电子数为6×5,所以用“双线桥法”标明反应中电子转移的方向和数目为: 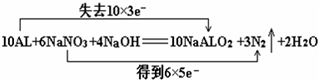 , 故答案为:  . |
相似问题
实验室常用NaNO2和NH4Cl反应制取N2.下列说法正确的是( )A.NaNO2是还原剂B.NH
实验室常用NaNO2和NH4Cl反应制取N2.下列说法正确的是( )A.NaNO2是还原剂B.NH4Cl中N元素被还原C.生成1molN2时转移6mol电子D.氧化剂和还原剂的物质的量之比是1:1
实验室为监测空气中汞蒸气的含量 往往悬挂涂有CuI的滤纸 根据滤纸是否变色或颜色发生变化所用去的时间
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg═Cu2Hg
Na2FeO4是一种高效多功能水处理剂 应用前景广阔.一种制备Na2FeO4的方法可用化学方程式表示
Na2FeO4是一种高效多功能水处理剂,应用前景广阔.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应
下列说法正确的是( )A.酸性氧化物就是非金属氧化物B.纯净物与混合物的区别是看是否只含有一种元素
下列说法正确的是( )A.酸性氧化物就是非金属氧化物B.纯净物与混合物的区别是看是否只含有一种元素C.强弱电解质的区别是溶液的导电能力的大小D.
火法炼铜的原理为:Cu2S+O2═2Cu+SO2 下列说法中 正确的是( )A.Cu2S 只做还原
火法炼铜的原理为:Cu2S+O2═2Cu+SO2,下列说法中,正确的是( )A.Cu2S只做还原剂B.O2发生氧化反应C.S元素被氧化D.当0 8molO2参加反应时,共转移了3 2mol电子












