现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐
| 现有下列十种物质: ①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3 (1)上述物质中属于电解质有:______(用物质序号填空),可以利用⑦具有______现象这一简单物理方法区分⑦、⑧二种分散系. (2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为______.少量的④通入⑥的溶液中反应的离子方程式为______. (3)17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为______,SO42-的物质的量浓度为______. (4)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,写出该反应的离子方程式并标出电子转移方向和数目:______.当有4.48升(标况)NO气体产生时,转移电子的物质的量为______,被还原HNO3 的质量为______克. |
参考解答
| (1)在水溶液里或熔融状态下能导电的化合物是电解质,③CaO、⑤H2SO4、⑥Ba(OH)2、⑩Al2(SO4)3是电解质;⑧氨水、⑨稀硝酸、⑦红褐色的氢氧化铁液体是混合物,不是电解质也不是非电解质;④CO2 是非电解质; ①H2、②铝既不是电解质也不是非电解质.⑦红褐色的氢氧化铁液体是胶体能产生丁达尔效应. 故答案为:③⑤⑥⑩;丁达尔. (2)H++OH-═H2O表示强酸和强碱的酸碱中和反应,且酸碱反应中只有水生成,强酸是硝酸,强碱是氢氧化钡,反应方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;少量二氧化碳和氢氧化钡反应生成碳酸钡和水,离子方程式为 Ba2++2OH-+CO2=BaCO3↓+H2O. 故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;Ba2++2OH-+CO2=BaCO3↓+H2O. (3)17.1gAl2(SO4)3的物质的量是
C=
故答案为:0.15NA;0.6mol/L. (4)强电解质写化学式,气体、弱电解质、金属单质写化学式, 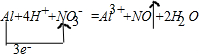 ; 设转移电子的物质的量是x,被还原的硝酸根的物质的量是y. Al+4H++NO3-=Al3++NO↑+2H2O转移电子 1mol 22.4L 3mol y 4.48L x 所以x=0.6mol y=0.2mol,被还原的硝酸根的物质的量等于被还原的硝酸的物质的量为0.2mol,所以被还原的硝酸的质量=0.2mol×63g/mol=12.6g, 故答案为: 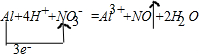 ;0.6mol;12.6g. |
相似问题
在Cu2S+2Cu2O △ . 6Cu+SO2↑反应中 说法正确的是( )A.Cu2O在反应中被氧
在Cu2S+2Cu2O△ 6Cu+SO2↑反应中,说法正确的是( )A.Cu2O在反应中被氧化B.Cu2S在反应中既是氧化剂又是还原剂C.Cu既是氧化产物又是还原产物D.若
(1)写出有关反应的化学方程式:①工业用氯气与熟石灰制取漂白粉______.②钠的一种化合物用作呼吸
(1)写出有关反应的化学方程式:①工业用氯气与熟石灰制取漂白粉______.②钠的一种化合物用作呼吸面具中的供氧剂______.(2)科学家发现,食用虾类等
溴的氧化性介于氯和碘的氧化性之间 利用这一性质解决下面的问题.你认为:将下列哪种试剂加入到含有Br-
溴的氧化性介于氯和碘的氧化性之间,利用这一性质解决下面的问题.你认为:将下列哪种试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2( )A.I2B.I-
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )A.2NaBr+Cl2=2CaCl+Br2B.AlCl3+3N
由一种阳离子与两种酸根离子组成的盐成为混盐.混盐CaOCl2在酸性条件下可以产生Cl2.下列关于混盐
由一种阳离子与两种酸根离子组成的盐成为混盐.混盐CaOCl2在酸性条件下可以产生Cl2.下列关于混盐CaOCl2的判断不正确的是( )A.该混盐与硫酸反应产












