(16分)有一含NaCl Na2CO3·10H2O和NaHCO3的混合物 某同学设计如下实验 通过测
(16分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。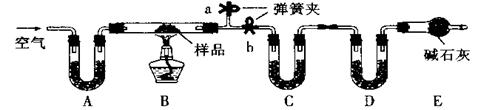 (1)实验时,B中发生反应的化学方程式为 , 。 (2)装置C、D中盛放的试剂分别为: C ,D (供选试剂为:浓硫酸、无水CaCl2、碱石灰) (3)E装置中的仪器名称是 ,它在该实验中的主要作用是 (4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”)。 (5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为: (结果用分数表示,可不化简)。 |
参考解答
(1)2NaHCO3  Na2 CO3 + H2O + CO2↑ Na2CO3·10H2O Na2 CO3 + H2O + CO2↑ Na2CO3·10H2O  Na2CO3 + 10H2O Na2CO3 + 10H2O(2)无水CaCl2 碱石灰 (3)(球形)干燥管 防止空气中的CO2和水蒸气进入影响测定结果 (4)偏低 (5)286(m1 - 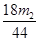 )/180m ×100% )/180m ×100% |
试题分析:(1)B中盛放的是固体混合物,所以加热时反应的方程式为2NaHCO3  Na2 CO3 + H2O + CO2↑、Na2CO3·10H2O Na2 CO3 + H2O + CO2↑、Na2CO3·10H2O  Na2CO3 + 10H2O。 Na2CO3 + 10H2O。(2)C是吸收水蒸气的,D是吸收CO2的,U形管中不能放液体干燥剂,所以试剂分别是无水CaCl2和碱石灰。 (3)根据E的结构可知,E是干燥管。由于空气中也含有水蒸气和CO2,所以E的作用是防止空气中的CO2和水蒸气进入影响测定结果。 (4)如果是氢氧化钠溶液,则水蒸气的含量将增加,则碳酸钠和碳酸氢钠的质量将增加,所以氯化钠的质量减少。 (5)生成CO2是m2g,则碳酸氢钠产生的水是m2/44×18g,所以碳酸钠生成的水是(m1-m2/44×18)g,所以碳酸钠晶体的质量是286(m1-18m2/44)/180,因此质量分数是286(m1-18m2/44)/180m ×100%。 点评:化学实验解题的关键就是要审清题意,然后分析好各个装置的作用,这样才能轻松解决每个问题。 |
相似问题
为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质 某同学先取2 mL试样于试管中 而后进行如下实验
为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2 mL试样于试管中,而后进行如下实验,其中不能达到目的的是:A.加入过量稀硫酸,观
金属钠着火时 可用来灭火的是A.二氧化碳B.水C.煤油D.沙土
金属钠着火时,可用来灭火的是A.二氧化碳B.水C.煤油D.沙土
钠应用于电光源上是由于( )A.高压钠灯发出的黄光射程远 透雾力强B.钠很软C.钠是一种强还原剂
钠应用于电光源上是由于()A.高压钠灯发出的黄光射程远,透雾力强B.钠很软C.钠是一种强还原剂D.钠燃烧发出黄色火焰
关于Na的描述正确的是( )①Na在自然界中既以游离态又以化合态形式存在;②金属Na着火可以用泡沫
关于Na的描述正确的是()①Na在自然界中既以游离态又以化合态形式存在;②金属Na着火可以用泡沫灭火器救火;③实验室中少量的Na保存在煤油里;④Na-K合
某兴趣小组设计如下装置进行氯气与金属钠的反应 先将钠预热 在钠熔融成小球时 撤火 并通入氯气即发生反
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是A.钠着火剧烈燃烧产生












