(12分)为测定放置已久的小苏打样品中纯碱的质量分数 设计如下实验方案:(1)方案一:称取一定质量的
| (12分)为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案: (1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是__________________________________。 (2)方案二:按如图装置进行实验,并回答以下问题。 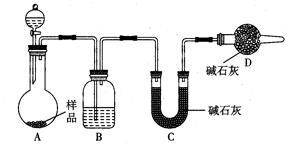 ①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀H2SO4装入分液漏斗中。D装置的作用是__________________________________________。 ②实验中除称量样品质量外,还需分别称量______________装置反应前后的质量(填装置的字母代号)。 ③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是______________________________________。 (3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤、干燥沉淀、称量固体质量、计算: ①实验中判断沉淀已完全的方法是__________________________________________ ___________________________________________________________________________。 ②如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________________________。 |
参考解答
| (1)使NaHCO3完全分解 (2)①防止空气中的CO2及水蒸气等进入C装置 ② C ③实验中产生的CO2气体不能完全被C中的碱石灰吸收。 (3)①将反应后的物质静置后,取上层清液少许于试管中,向其中加入一定量的Na2SO4溶液,若溶液变浑浊则沉淀已完全。(或取上层清液,再加BaCl2溶液,若溶液不变浑浊则沉淀已完全。) ②55.8% (或56%等合理数据) |
| 考查钠的碳酸盐的性质及物质的测定、方案设计。 (1)采取直接加热的方法,原理简单,依据化学方程式即可计算出结果。为保证使NaHCO3完全分解,必须将样品加热至恒重 (2)使样品与酸反应,通过测定生成的CO2的量来计算出结果。本方案需要保证生成的CO2全部被碱石灰吸收,并且要防止空气的CO2、水进入装置内。 (3)采用沉淀的方式来推算出结果。依据所给数据,可计算出两碳酸盐的物质的量均为0.05mol,进而可算出样品中碳酸钠的质量分数为55.8% |
相似问题
金属钠在空气中久置后变质为( )A.NaOHB.Na2OC.Na2O2D.Na2CO3
金属钠在空气中久置后变质为()A.NaOHB.Na2OC.Na2O2D.Na2CO3
下列叙述正确的是A.向含有 CaCO3沉淀的水中通入CO2至沉淀恰好溶解 再向溶液中加入NaHCO3
下列叙述正确的是A.向含有 CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成B.向Na2CO3溶液中逐滴加入等物质的
纯碱和小苏打是厨房中两种常见的用品 它们都是白色固体。下列区分这两种物质的方法正确的是
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是()A.分别用炒锅加热两种样品质量减少的是苏打B.用洁净铁
已知X Y中含有相同的元素 Z W中也含有相同的元素 根据反应X+H2OY+H2↑;Z+H2OW+O
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2OY+H2↑;Z+H2OW+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高
在实验室里 某同学取一小块金属钠做与水反应的实验。试完成下列问题:切开的金属钠暴露在空气中 最先观察
在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:切开的金属钠暴露在空气中,最先观察到的现象是,所发生反应的化学方程式是。(2)将












