常温下 将一定量的钠铝合金置于水中 合金全部溶解 得到200mL C(OH-)=0.1mol/L的溶
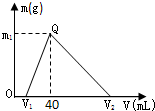
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL C(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
 |
参考解答
| 由图象可知,向合金溶解后的溶液中加盐酸,先发生NaOH+HCl═NaCl+H2O,后发生NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,最后发生Al(OH)3↓+3HCl═AlCl3+3H2O, 合金溶解后剩余的氢氧化钠的物质的量为0.2L×0.1mol/L=0.02mol,由NaOH+HCl═NaCl+H2O,则V1为
0.02mol 0.02mol 0.02mol A、由钠元素及铝元素守恒可知,合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A错误; B、由Al(OH)3↓+3HCl═AlCl3+3H2O可知,溶解沉淀需要0.06molHCl,其体积为60mL,则V2为40mL+60mL=100mL,故B错误; C、由2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,加盐酸后,先发生NaOH+HCl═NaCl+H2O,后发生NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,最后发生Al(OH)3↓+3HCl═AlCl3+3H2O,随着盐酸的量的加入,体积增大,钠离子的量不变,所以浓度减小,故C错误; D、由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故D正确; 故选D. |
相似问题
下图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去)。 已知:E为红
下图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去)。 已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工
钠和铝是两种重要的金属.请回答:(1)将一小块金属钠投入水中 可观察到的实验现象是______(填序
钠和铝是两种重要的金属.请回答:(1)将一小块金属钠投入水中,可观察到的实验现象是______(填序号).a.钠沉到水底b.钠熔成小球c.小球四处游动(2
A是用途最广的金属 B C是两种常见气体单质 E溶液为常见强酸 D溶液中滴加KSCN溶液显血红色 它
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。请回答:(1)写出B物质的化学
类推思维是化学解题中常用的一种思维方法 下列有关离子方程式的类推正确的是( )已知类推A将Fe加入
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )已知类推A将Fe加入到CuSO4溶液中Fe+Cu2+=Cu+Fe2+将Na加入到CuSO4溶
钠 铝和铁是三种重要的金属.请回答:(1)钠原子的结构示意图是______.(2)三种金属中 既能与
钠、铝和铁是三种重要的金属.请回答:(1)钠原子的结构示意图是______.(2)三种金属中,既能与盐酸又能与氢氧化钠溶液反应的是______(填化学式),












