实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。[分析与猜想](1)根据过氧化
| 实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。 [分析与猜想] (1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O =" 4NaOH" + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想: A.氧气有漂白性 B.氢氧化钠有漂白性 C. [实验与判断] 请完成下列表格:
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。 (3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。 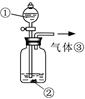 A.酚酞试剂 B.过氧化钠与水反应后的溶液 C.二氧化锰 D.氢氧化钠固体配制的溶液 (4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。 | ||||||||||||||||||||
参考解答
| (1)氧气和氢氧化钠共同作用具有漂白性 B A 氢氧化钠固体(各1分共3分) (2)H2O2 (3)B C (各1分) (4)O2(1分) H2O2不稳定,已分解 |
试题分析:(1)结合A、B,C的猜想是氧气和氢氧化钠共同作用具有漂白性,所以实验1对应的是B,实验3对应的是A;氢氧化钠溶液是用氢氧化钠固体配制的,因为氧化钠固体空气中易变质,造成所配溶液 不纯,过氧化钠固体与水作用除生成氢氧化钠外还会有氧气生成,给实验带来干扰 (2)钠元素形成了稳定的化合物即氢氧化钠,另一种不很稳定、具有漂白性的物质X应是过氧化氢, 其化学式为H2O2 (3)过氧化氢在二氧化锰作催化剂的条件下分解产生氧气,氧气 可用带火星的木条检验,所以①处装 入的物质过氧化钠与水反应后的溶液,选B,②处装入的物质是二氧化锰,选C。 (4)气体③是氧气,因为过氧化氢不稳定,分解产生氧气,所以在书写过氧化钠与水的反应方程式时不写出 |
相似问题
某课外小组欲测定过氧化钠与碳酸钠混合物中过氧化钠的质量分数 准确称量a克样品 下列后续实验方案中 不
某课外小组欲测定过氧化钠与碳酸钠混合物中过氧化钠的质量分数,准确称量a克样品,下列后续实验方案中,不合理的是A.隔绝空气加热,冷却后,称量剩余固
将一小块钠投入盛饱和澄清石灰水的试管里 不可能观察到的现象是 [ ]A.熔成小球并在液面上游
将一小块钠投入盛饱和澄清石灰水的试管里,不可能观察到的现象是 [ ]A.熔成小球并在液面上游动 B.有气体生成 C.溶液底部有银白色物质生成D.溶液变浑浊
钠在自然界中只能以____态存在 主要以____(填物质名称)的形式存在。金属钠通常保存在_____
钠在自然界中只能以____态存在,主要以____(填物质名称)的形式存在。金属钠通常保存在______里,它可以用小刀切割,新切开的金属钠断面呈_______色,在
下列物质与金属钠反应最剧烈的是[ ]A.水 B.HCl溶液 C.NaOH溶液D.NaCl溶液
下列物质与金属钠反应最剧烈的是[ ]A.水 B.HCl溶液 C.NaOH溶液D.NaCl溶液
将少量金属钠放入盛有CuSO4溶液的烧杯中 剧烈反应 有蓝色沉淀及无色气体产生。则烧杯中发生的反应是
将少量金属钠放入盛有CuSO4溶液的烧杯中,剧烈反应,有蓝色沉淀及无色气体产生。则烧杯中发生的反应是[ ]A.2Na+CuSO4==Na2SO4+CuB.Cu+2H2O==Cu(OH)2↓