已知D H是常见的非金属单质 其中H是黄绿色气体.J是一种金属单质 J元素的+2价化合物比+4价化合
| 已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol H同时消耗4mol B和1mol C.它们之间的关系如图: (1)写出物质A的化学式______. (2)写出反应②的化学方程式______. (3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号). ①热分解法 ②热还原法 ③电解法 其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol. (4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为______,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol. (5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______ 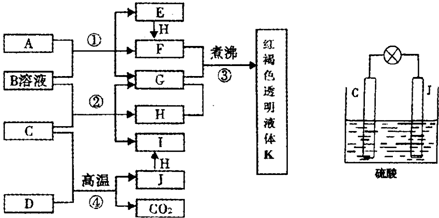 |
参考解答
| H是黄绿色气体,为Cl2,D是形成化合物种类最多的元素,所以D是碳,D、J元素在周期表中同主族,J是一种金属单质,J元素的+2价化合物比+4价化合物稳定,所以J是Pb,C+D→Pb+CO2,C是金属氧化物,所以C是PbO,PbO+B→Cl2+G+I,B与C反应时,每生成1mol H同时消耗4mol B和1mol C,根据得失电子守恒知,B是HCl,A是金属氧化物,A+盐酸→E+F+G,E和氯气反应生成F,所以A中金属元素是变价元素,为铁元素,A是四氧化三铁,E是氯化亚铁,F是氯化铁,G是水,I是PbCl2,氯化铁溶液煮沸得氢氧化铁胶体K. (1)通过以上分析知,A是Fe3O4,故答案为:Fe3O4; (2)二氧化铅和盐酸反应生成氯化铅、氯气和水,反应方程式为:PbO2+4HCl=PbCl2+Cl2↑+2H2O, 故答案为:PbO2+4HCl=PbCl2+Cl2↑+2H2O (3)铁和铅属于较活泼金属,采用热还原法冶炼,故选②; 设转移电子的物质的量是x. 3Fe3O4+8Al
3mol 24mol 1mol x x=8mol 故答案为:②;8; (4)用C、J作电极,与硫酸构成的原电池中,铅失电子,二氧化铅得电子,与硫酸反应生成硫酸铅和水,反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O, 设消耗硫酸的物质的量是y. Pb+PbO2+2H2SO4=2PbSO4+2H2O转移电子 2mol 2mol y 1mol y=1mol,1mol硫酸中氢离子的物质的量是2mol, 故答案为:Pb+PbO2+2H2SO4=2PbSO4+2H2O;2; (5)向胶体中滴加电解质溶液会产生聚沉现象,氢氧化铁又能和盐酸反应生成可溶性盐,所以沉淀会溶解, 故答案为:开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解. |
相似问题
A B C D四种元素原子的核电荷数依次增大(均小于20) 其单质及相应的化合物能发生如下反应关系:
A、B、C、D四种元素原子的核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系: (1)写出F的电子式____________。(2)气体H有毒
下列各组物质中 不是按(“→”表示一步完成)关系相互转化的是( )选项ABCDaFeCH2=CH2
下列各组物质中,不是按(“→”表示一步完成)关系相互转化的是( )选项ABCDaFeCH2=CH2Al(OH)3H2SO4bFeCl3CH3-CH2BrNaAlO2SO2cFeCl2CH3CH2OHAl2O3SO3A.AB.BC.CD.D
已知有以下物质相互转化。试回答: (1)写出B的化学式_________ D的化学式______
已知有以下物质相互转化。试回答: (1)写出B的化学式_________,D的化学式__________。 (2)写出由E转变成F的化学方程式____________ 。 (3)写出用K
甲 乙 丙三种物质之间有如下转化关系:(1)若乙溶液中加入KSCN溶液 有血红色出现 则甲物质是:_
甲、乙、丙三种物质之间有如下转化关系:(1)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:______.写出“甲→乙”转化的离子方程式:______.(
明明同学欲探究一块棕黑色块状固体的主要成分(仅由两种元素组成).将该固体溶于稀盐酸后 有气体A放出
明明同学欲探究一块棕黑色块状固体的主要成分(仅由两种元素组成).将该固体溶于稀盐酸后,有气体A放出,并得到浅绿色溶液B.A在空气中充分燃烧,又得到












