甲 乙两同学欲分别完成“钠与氯气反应”的实验.I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层)
| 甲、乙两同学欲分别完成“钠与氯气反应”的实验. I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I).该方案的不足之处有______(至少答出两点). II.乙同学所采用的装置如图Ⅱ,回答下列问题: 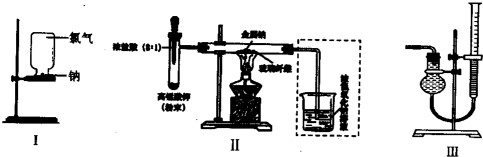 (1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为______;待装置中出现______现象后,点燃酒精灯. (2)点燃酒精灯后,玻璃管中出现的现象是______.(至少答出三点) (3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积. ①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是______(填“酸式”或“碱式”)滴定管. ②为提高测量的准确性,图Ⅲ装置中的液体可用______;收集完气体并冷却至室温后读数,读数前应进行的操作是______. ③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积______(填“偏大”、“偏小”或“无影响”). |
参考解答
| Ⅰ钠预先在空气中加热,会生成氧化钠,使氯气与钠难以反应,影响钠在氯气中的燃烧,放在石棉网上,用酒精灯微热,当盛有氯气的集气瓶倒扣时,会有少量氯气泄漏,污染环境; 故答案为:钠预先在空气中加热,会生成氧化物,影响钠在氯气中燃烧;实验过程中会产生少量污染; Ⅱ(1)高锰酸钾具有强氧化性,与浓盐酸反应生成氯气,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,氯气呈黄绿色,当整个装置充满黄绿色气体时,开始点燃酒精灯,可充分反应, 故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;整个装置充满黄绿色气体; (2)钠熔点低,与氯气在加热时剧烈反应,放出大量的热,生成NaCl,产生白烟,火焰呈黄色, 故答案为:钠熔化并燃烧,产生黄色火焰,有白烟; (3)①量气装置用简式滴定管,直接连接橡皮管,易于操作,故答案为:碱式; ②氯气不溶于饱和食盐水,为减少氯气的损失,应用饱和食盐水,读数时,应使左右压强相等保证读数准确,可上下移动滴定管,使左右两边液面相平, 故答案为:饱和NaCl溶液;上下移动滴定管,使左右两边液面相平; ③俯视时,读数偏小,与开始的体积之差偏大,故答案为:偏大. |
相似问题
将3.72 g 结晶 Na2CO3·xH2O 加热至500 ℃ 经过足够长的时间 固体质量不再发生改
将3 72 g 结晶 Na2CO3·xH2O 加热至500 ℃,经过足够长的时间,固体质量不再发生改变,冷却称量,质量为3 18 g,则x值为()A.1B.2C.6D.10
现有碳酸钠和碳酸氢钠的混合物7.4 g 与足量盐酸反应后 生成二氧化碳气体3.3 g。求碳酸钠在混合
现有碳酸钠和碳酸氢钠的混合物7 4 g,与足量盐酸反应后,生成二氧化碳气体3 3 g。求碳酸钠在混合物中的质量分数。
含有1.4 g某碱金属及其氧化物的混合物 跟水完全反应后 蒸干溶液得到不含结晶水的固体1.79 g
含有1 4 g某碱金属及其氧化物的混合物,跟水完全反应后,蒸干溶液得到不含结晶水的固体1 79 g,则该混合物中碱金属元素的质量分数为多少?
下列离子方程式错误的是( )A.铝粉投入到NaOH溶液中2Al+2OH-====2+2H2OB
下列离子方程式错误的是( )A.铝粉投入到NaOH溶液中2Al+2OH-====2+2H2OB.Al(OH)3溶于NaOH溶液Al(OH)3+OH-====+2H2OC.Al(OH)3溶于HCl溶液Al(OH)3+3H+==
相同温度下 在甲 乙 丙 丁四个烧杯中分别盛有等体积 等物质的量浓度的NaOH不饱和溶液 分别加入N
相同温度下,在甲、乙、丙、丁四个烧杯中分别盛有等体积、等物质的量浓度的NaOH不饱和溶液,分别加入Na、Na2O、Na2O2、NaOH并恢复至原温度,使恰好都形成












