我们知道 高温煅烧石灰石(主要成份是碳酸钙)可制得生石灰(即氧化钙)和二氧化碳。为了分析产品的纯度
| 我们知道,高温煅烧石灰石(主要成份是碳酸钙)可制得生石灰(即氧化钙)和二氧化碳。为了分析产品的纯度,小舜同学取石灰石样品22g,充分煅烧后称得剩余固体的质量为13.2g(提示:假定杂质不反应)。计算: (1)生成二氧化碳的质量是多少克?这些二氧化碳在标准状况下的体积是多少升?(标准状况下CO2的密度1.977g/L) (2)制得生石灰的质量是多少克?其产品的纯度是多少? |
参考解答
| 解:(1)根据质量守恒定律可知, 生成二氧化碳的质量为:22g-13.2g=8.8g。 二氧化碳的体积为:8.8g÷1.977g/L=4.45L (2)设生成生石灰的质量为x CaCO3  CaO + CO2↑ CaO + CO2↑56 44 x 8.8g 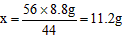 则所得产品的纯度为:(11.2g/13.2g)×100%=84.85% |
相似问题
甲 乙 丙三位同学用下列试剂分别进行实验 所取试剂用量如下表所示 且反应均恰好完全。已知:A1+A2
甲、乙、丙三位同学用下列试剂分别进行实验,所取试剂用量如下表所示,且反应均恰好完全。已知:A1+A2+A3=23 0g,B1+B2+B3=219 0g,现将甲、乙、丙三位同
某化工厂排放的废水中含有HCl会造成水体的严重污染。经测定 某工厂产生的废水中 HCl的质量分数为0
某化工厂排放的废水中含有HCl会造成水体的严重污染。经测定,某工厂产生的废水中,HCl的质量分数为0 73%,为保证该厂每天产生的100吨废水无害排放,必须
下面是某学生做的一道计算题 请指出他的错误。题目:3.25gZn和足量的盐酸(HCl)反应制取H2
下面是某学生做的一道计算题,请指出他的错误。题目:3 25gZn和足量的盐酸(HCl)反应制取H2,同时还生成ZnCl2。求可制得H2的质量是多少?解:设可制得H2的
在一次化学课外活动中 化学老师要求同学们将30gNaCl样品中的杂质CuCl2 除去 同时测出其中所
在一次化学课外活动中,化学老师要求同学们将30gNaCl样品中的杂质CuCl2,除去,同时测出其中所含CuCl2的质量分数。老师提供的试剂有:一定质量分数的NaOH
将14g硫在一定量的氧气中燃烧 记录如下数据:分析数据 回答下列问题。(1)在这三次实验中 第___
将14g硫在一定量的氧气中燃烧,记录如下数据:分析数据,回答下列问题。(1)在这三次实验中,第____次刚好完全反应;(2)在第_____次实验中硫有剩余,剩余_












