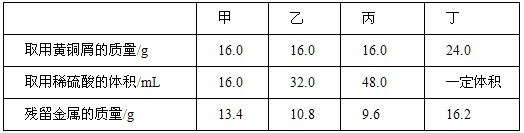
为了测定黄铜屑(有锌和铜形成的合金)样品组成 甲 乙 丙 丁四位同学分别取样和稀硫酸反应(稀硫酸的密
| 为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下: |
|
| (1)上表中n的数值为________。 (2)样品中碳酸钙的质量分数是_____。 (3)求盐酸中溶质的质量分数。 |
参考解答
| (1)从甲、乙、丙三位同学取稀硫酸的体积及残留金属的质量分析,丙同学取用硫酸过量。所以,16.0g黄铜屑中锌的质量为:16.0g-9.6g=6.4g (2)设甲同学消耗硫酸的质量为x Zn+H2SO4==ZnSO4+H2↑ 65 98 16.0g-13.4g x x=98×(16.0g-13.4g)/65=3.92g 稀硫酸的溶质质量分数为: 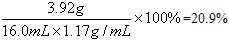 丁同学消耗锌的质量分数为:24.0g-16.2g=7.8g 设:丁同学实验消耗H2SO4的质量为y Zn+H2SO4=ZnSO4+H2↑ 65 98 7.8g y y=11.76g 所以,丁同学取用稀硫酸的质量为11.76g/20.9%=56.27g 体积为:56.27g÷1.17g/mL=48 mL 答:(1)16.0g黄铜屑中锌的质量为6.4g (2)丁同学所加稀硫酸的体积为48mL |
相似问题
学习了氨碱法制取纯碱的知识后 化学兴趣小组的同学对纯碱的性质进行了初步探究 分别做了纯碱与盐酸 氯化
学习了氨碱法制取纯碱的知识后,化学兴趣小组的同学对纯碱的性质进行了初步探究,分别做了纯碱与盐酸、氯化钡等物质反应的实验。实验结束后,同学们把“
海洋约占地球表面积的71% 具有十分巨大的开发潜力。苦卤是海水提取食盐后的残液 利用苦卤可以制得金属
海洋约占地球表面积的71%,具有十分巨大的开发潜力。苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料。下图是我市某盐场苦卤中部分成分含
在一定质量的硫酸溶液中加入氯化钡溶液直到反应完全 产生沉淀的质量与原硫酸溶液的质量相等 则原硫酸溶液
在一定质量的硫酸溶液中加入氯化钡溶液直到反应完全,产生沉淀的质量与原硫酸溶液的质量相等,则原硫酸溶液中H2SO4的质量分数为[ ]A 42%B 36%C 30%D 24%
过氧化钠(Na2O2)与水发生反应 生成对应的碱和氧气 化学方程式为:2Na2O2+2H2O==4N
过氧化钠(Na2O2)与水发生反应,生成对应的碱和氧气,化学方程式为:2Na2O2+2H2O==4NaOH+O2↑。现将78g过氧化钠放入338g水中,充分反应。试计算:(1)
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。某化学兴趣小组为了测定纯碱样品中
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质)。某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱