(15分)能源是国民经济发展的重要基础 我国目前使用的能源主要是化石燃料。(1)在25℃ 101 k
| (15分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。 (1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。 (2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1 H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1 CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1 则煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。 (3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。 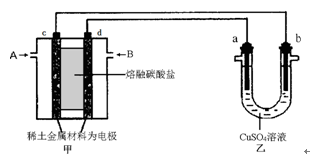 ①甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为_____________。 ②乙装置中a极上的电极反应式为____________________________。 若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化) ③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。 |
参考解答
| (11分) (1) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.31kJ·mol-1 (2)131.5 (3)①CO2 O2+4e-+2CO2=2CO32- ②4OH--4e- = O2↑+2H2O 56 1 ③(w×142/322)/( w+18a)×100% |
| (1)根据101kPa时,1mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量,可知甲烷燃烧的热化学方程式。 (2)物质和能量紧密相关,以物质变化为基础,物质怎么变,能量就跟着怎么变。?-?-?即可等到目标式。反应热也是?-?-?来计算。 (3)b极上有红色物质析出,b极为阴极;?A为电源负极,通甲烷气体;B为正极通氧气,相关方程式:O2+4e-+2CO2=2CO32-。?a为电解池的阳极,相关电极反应:4OH--4e- = O2↑+2H2O ;③电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液. w g Na2SO4?10H2O硫酸钠的质量='w' g× 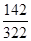 ×100%; ×100%;设电解水的质量为x: 2H2O=2H2↑+O2↑ 36g 1mol x amol x=18ag 所以饱和溶液的质量分数= 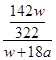 ×100%. ×100%. |
相似问题
(8分)A B C D E五种短周期元素的原子序数依次增大 上述元素中只有一种金属元素。A B同周期
(8分)A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又
下列叙述中正确的是A.同温同压下 H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的
下列叙述中正确的是A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的AH不同B.常温下,反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应
(4分)(1) 家用液化气的主要成分之一是丁烷 当58g丁烷完全燃烧并生成二氧化碳和液态水时 放出热
(4分)(1) 家用液化气的主要成分之一是丁烷,当58g丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2900kJ,试写出表示丁烷燃烧热的热化学方程式:(
含有共价键的离子化合物是A.MgCl2B.HBrC.N2D.KOH
含有共价键的离子化合物是A.MgCl2B.HBrC.N2D.KOH
下列物质中属于共价化合物的是
下列物质中属于共价化合物的是 A.Cl2B.NH4ClC.C2H6D.NaOH












