(14分)超细铜粉主要应用于导电材料 催化剂等领域中。超细铜粉的某制备方法如下:试回答下列问题:(1
(14分)超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下: 试回答下列问题: (1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。 (4)NH3易液化的原因是___________________。 (5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为__ 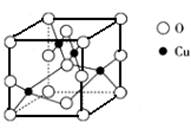 ___________。 ___________。(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。 |
参考解答
| (14分) (1) AD(2分) (2) [Ar]3d10(2分) (3) sp3、NF3(或PF3、NCl3、PCl3等)( 各2分) (4) NH3分子间可形成氢键。(2分) (5) CuO(2分) (6)2NH4CuSO3 + 4H+  2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O(2分) 2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O(2分) |
超细铜粉的某制备方法为: (1)A.[Cu(NH3)4SO4为络合物,NH3中包含极性共价键,与Cu2+形成配位键,铜铵络离子与硫酸根离子以离子键结合,正确 B.[Cu(NH3)4SO4作为络合物,水溶液中可电离出铜铵络离子及硫酸根离子,不可能含有NH3分子,不正确 C.[Cu(NH3)4SO4的组成元素中第一电离能最大的是氮元素,不正确 D.SO42—的中心原子S为sp3杂化,与四个O原子形成了正四面体的空间构型,正确 (2)Cu+为+1价亚铜离子,电子排布式为[Ar]3d10 (3)SO2–3 离子中S硫原子价键电子对是4,故为sp3杂化; 等电子体:原子总数及价电子总数均相等,例如NF3、PF3、NCl3、PCl3等 (4)NH3分子间可形成氢键,使其沸点较高,易液化 (5)晶胞中O原子个数: 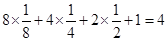 ,而铜原子为4个,即其化学式为CuO ,而铜原子为4个,即其化学式为CuO(6)NH4CuSO3在酸性溶液中,亚硫酸根离子与氢离子可生成SO2及水及铵根离子,Cu+在酸性条件下发生岐化反应,可得到Cu2+ 、Cu,故离子方程式为:2NH4CuSO3 + 4H+  2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O 2NH4+ + Cu2+ + Cu + 2SO2↑ + 2H2O |
相似问题
下列化学式中 能真实地表示物质一个分子的是……( ) A.CsCl B.CO2C.C4H10D.Si
下列化学式中,能真实地表示物质一个分子的是……( ) A.CsCl B.CO2C.C4H10D.SiO2
最近日本科学家确认世界上还存在的另一种“分子足球”N60 它与C60的结构相似。下列说法正确的是(
最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似。下列说法正确的是()A.N60是一种新型化合物B.N60和14N都是氮的同位素C
向盛有硫酸铜水溶液的试管里加入氨水 首先形成难溶物 继续滴加氨水 难溶物溶解得到深蓝色透明溶液。若加
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液。若加入乙醇将析出深蓝色晶体。下列说法不正确的是
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是()A.该物质的分子式
A B C三种物质 每个分子中都含有18个电子且B C均为两种元素组成的化合物。其中A的分子属于非极
A、B、C三种物质,每个分子中都含有18个电子且B、C均为两种元素组成的化合物。其中A的分子属于非极性分子,且只有非极性键;B的分子由四个原子构成,既有












