(1)纳米技术制成的金属燃料 非金属固体燃料 氢气等已应用到社会生活和高科技领域.单位质量的A和B单
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
②ACl2分子中A的杂化类型为______,ACl2空间构型为______. (2)Fe原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物. ①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______. ②六氰合亚铁离子[Fe(CN)6]4-中不存在______. A.共价键 B.非极性键 C.配位键 D.σ键 E.π键 写出一种与CN-互为等电子体的单质的分子式______. (3)一种Al-Fe合金的立体晶胞如图2所示,请据此回答下列问题: ①确定该合金的化学式______. ②若晶体的密度为ρg-cm-3,该晶胞棱长为______cm(用含ρ和NA的代数式表示,不必化简. 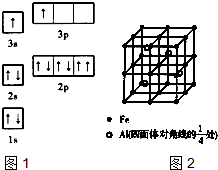 |
参考解答
| (1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中S区, 故答案为:能量最低原理、泡利原理;S; ②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:SP;直线; (2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,故答案为:具有孤对电子; ②六氰合亚铁离子[Fe(CN)64-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,故答案为:B;N2; (3)①由晶胞图2,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为8×
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为
|
相似问题
(一)下列是A B C D E五种短周期元素的某些些性质 (1)元素A是形成有机物的主要元素 下列分
(一)下列是A、B、C、D、E五种短周期元素的某些些性质 (1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________ A.B.CH4 C
下列关于[Cu(NH3)4]SO4的说法中 正确的有( )A.[Cu(NH3)4]SO4中所含的化
下列关于[Cu(NH3)4]SO4的说法中,正确的有( )A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键B.[Cu(NH3)4]SO4含有NH3分子,其水溶
下列配合物的水溶液中加入硝酸银不能生成沉淀的[ ]A.[Co(NH3)4Cl2]Cl B
下列配合物的水溶液中加入硝酸银不能生成沉淀的[ ]A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3] C.[Co(NH3)6]Cl3 D.[Cu(NH3)4]Cl2
Ⅰ.砷化镓为第三代半导体 以其为材料制造的灯泡寿命长 耗能少。已知砷化镓的晶胞结构如图所示。请回答下
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:(1)下列说法正确的是____(填序号)。
韩国首尔大学的科学家将水置于一个足够强的电场中 在20℃时 水分子瞬间凝固形成“暖冰”.下列关于“暖
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )A.暖冰中水分子是直












