碳 硅元素的单质及其化合物是构成自然界的重要物质。(1)甲烷是最简单的有机物 实验室可通过下列反应制
| 碳、硅元素的单质及其化合物是构成自然界的重要物质。 (1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH  CH4↑+X(已配平) CH4↑+X(已配平)①X属于 晶体(填晶体类型)。 ②MgO晶体的熔点比CaO高,主要原因是 。 (2)金刚石和石墨是两种重要的碳单质。 ①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。 ②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。 (3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3 该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”) (4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的 是 (填标号)。 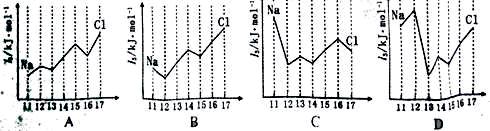 |
参考解答
| (8分)(1)①离子 (1分)②Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高(2分) (2)①3 (1分)②自由电子(1分)(3)极性键或σ键;(1分)<(1分)(4)D(1分) |
试题分析:(1)①根据原子守恒可知,X应该是碳酸钠,属于离子晶体。 ②氧化镁和氧化钙都是离子晶体,由于Mg2+半径比Ca2+小,因此MgO晶体的晶格能较大,熔点较高。 (2)①根据基态Cr3+离子的核外电子排布可知,含有的未成对电子数有3个。 ②K是金属,得到是靠自由电子,所以该导电的粒子是自由电子。 (3)甲烷是分子晶体,由于硅烷(SiH4)的结构与甲烷相似,所以SiH4分子中共价键的类型是极性键。氢元素被氧化,这说明在SiH4分子中氢元素的化合价是-1价,由此可判断电负性是Si<H。 (4)镁失去2个电子后,就已经达到稳定结构,所以镁的第三电离能最大,答案选D。 点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,综合性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。 |
相似问题
由碳原子构成的纳米碳管可以作为储存氢气的优良容器 其单层部分结构示意图如下 下列说法正确的是A.纳米
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是A.纳米碳管是一种无机化合物B.纳米碳管中碳原子间以
氮化硼是一种新合成的结构材料 它是超硬 耐磨 耐高温的物质 下列各组物质熔化时所克服的粒子间的作用与
氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是A.C6
已知某金属单质晶体中(如碱金属)原子堆积方式如下图所示 则该堆积方式是( )A.简单立方堆积B.体心
已知某金属单质晶体中(如碱金属)原子堆积方式如下图所示,则该堆积方式是()A.简单立方堆积B.体心立方堆积C.六方最密堆积D.面心立方最密堆积
下列说法正确的是( )A 钛和钾都采取下面的堆积方式 B 下图为金属原子在二维空间里的非密置层放置
下列说法正确的是()A钛和钾都采取下面的堆积方式B下图为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积C若以中学教材
关于晶体的叙述中 正确的是A.原子晶体中 共价键的键能越大 熔 沸点越高B.分子晶体中 分子间的作用
关于晶体的叙述中,正确的是A.原子晶体中,共价键的键能越大,熔、沸点越高B.分子晶体中,分子间的作用力越大,该分子越稳定C.分子晶体中,共价键的键












