(选做题)(19分)图表法 模型法是常用的科学研究方法。I.下图是研究部分元素的氢化物的沸点变化规律
| (选做题)(19分)图表法、模型法是常用的科学研究方法。 I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。 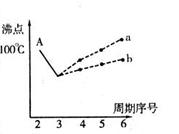 II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题: (1)22Ti元素基态原子的价电子层排布式为 。 (2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。 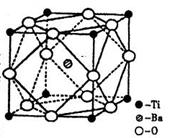 III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。 (1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。 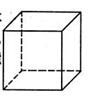 (2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物, 其可能原因是 (填字母代号)
|
参考解答
Ⅰ.b(2分) A点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水。(4分) Ⅱ.(1)3d24s2(2分) (2)BaTiO3(3分) Ⅲ.(1)正方体的八个顶点和六个面心(4分) (2)C(2分) (3)极性(2分) |
| 略 |
相似问题
下列物质中 含离子键和非极性共价键的是 ( )A.C
下列物质中,含离子键和非极性共价键的是()A.Cl2B.H2O2C.NaOHD.Na2O2
金晶体是面心立方体 立方体的每个面5个金原子紧密堆砌(如图其余各面省略) 金原子半径为R 摩尔质量
金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为R ,摩尔质量为M,阿伏加德罗常数为NA,求(1)金晶体中最小的一
下面关于SiO2晶体网状结构的叙述正确的是A.每个Si原子周围结合2个O原子B.SiO2是其分子式C
下面关于SiO2晶体网状结构的叙述正确的是A.每个Si原子周围结合2个O原子B.SiO2是其分子式C.1molSiO2含2molSi?O键D.最小的环上,有6个Si原子和6个O原子
下列物质固态时熔点的比较正确的是( )A.F2>Cl2>Br2B.金刚石>NaCl>O2C.S>N
下列物质固态时熔点的比较正确的是( )A.F2>Cl2>Br2B.金刚石>NaCl>O2C.S>NaBr>金刚石D.Na>CH4>冰
下列物质 按其晶体的熔点由高到低顺序排列的是( )A.H2O H2S H2Se H2TB.Cs Rb
下列物质,按其晶体的熔点由高到低顺序排列的是()A.H2O、H2S、H2Se、H2TB.Cs、Rb、K、NaC.SiO2、NaCl、CCl4、SO2D.F2、Cl2、Br2、I2












