X Y Z U为原子序数依次增大的前四周期元素 X Y Z三种元素位于同一周期 其中基态Y原子的2p
| X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题: (1)U单质的原子堆积方式为 ,Y的简单氢化物分子式为 。 (2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为________。 (3)化合物甲由Z、U两元素组成,其晶胞如图所示。 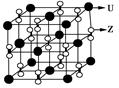 ①甲的化学式为______________。 ②下列有关该晶体的说法中正确的是________(选填选项字母)。 A.每个晶胞中含有14个U+ 和13个Z2- B.晶体中每个U+ 周围距离U+ 最近的Z2- 有6个 C.该晶体属于离子晶体 ③甲的密度为a g·cm-3,则晶胞的体积是________________cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。 |
参考解答
| (1)体心立方堆积 ; NH3; (2)5∶1; (3)①KO2 ; ②BC ; ③ 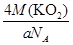 (或 (或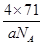 或 或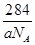 ) ) |
试题分析:X、Y、Z、U为原子序数依次增大的前四周期元素,基态Y原子的2p轨道处于半充满状态,则外围排布为2s22p3,因此Y为氮元素;X、Y、Z三种元素位于同一周期,且XZ2与Y2Z互为等电子体,因此符合条件的化合物只能是CO2与N2O,故X为碳元素、Z为氧元素;含U的化合物的焰色为紫色,则U为钾元素。 (1)U为钾元素,K单质的原子堆积方式为体心立方堆积;N元素的简单氢化物分子式为NH3。 (2)X为碳元素,一种氢化物的相对分子质量为28,则该氢化物为C2H4,分子中含有1个碳碳双键、4个C-H。碳碳双键含有1个σ键、1个π键,单键都为σ键,因此C2H4分子中σ键与π键的键数之比为5:1。 (3)化合物甲由Z、U两元素组成,其晶胞如图所示。 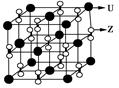 ①由晶胞结构并依据均摊法可知,晶胞中K原子数目=8× 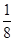 +6× +6×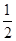 =4。O原子数目=2×12× =4。O原子数目=2×12×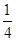 +2=8,故K原子与O原子数目之比为4:8=1:2,所以甲的化学式为KO2。 +2=8,故K原子与O原子数目之比为4:8=1:2,所以甲的化学式为KO2。②A、由①中计算可知,每个晶胞中含有4个K+和4O2-,故A错误;B、由晶胞结构可知,晶体中每个K+周围距离K+最近的O2-有6个(即上下、左右和前后个1个),故B正确;C、该晶体由K+和O2-构成,属于离子晶体,故C正确,答案选BC。 ③晶胞含有4个钾离子,则晶胞的质量= 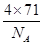 g,因为甲的密度为a g?cm-3,所以晶胞的体积= g,因为甲的密度为a g?cm-3,所以晶胞的体积=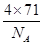 g÷ag?cm-3= g÷ag?cm-3=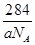 cm3。 cm3。 |
相似问题
第四周期过渡元素Fe Ti可与C H N O形成多种化合物。(1)①H C N O四种元素的电负性由
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。(1)①H、C、N、O四种元素的电负性由小到大的顺序为____________。②下列叙述不正确的是________
现有A B C D四种元素 A元素形成的-2价阴离子比氦原子的核外电子数多8个 B元素与A元素形成的
现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;
现有A B C D E F原子序数依次增大的六种元素 它们位于元素周期表的前四周期 B元素原子的价层
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中
用48 mL 0.1 mol/L的FeSO4溶液 恰好还原2.4×10-3 mol[RO(OH)2]
用48mL0 1mol L的FeSO4溶液,恰好还原2 4×10-3mol[RO(OH)2]+离子,则R元素的最终价态为 [ ]A.+2价 B.+3价 C.+4价 D.+5价
【化学—物质结构与性质】(15分)许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列
【化学—物质结构与性质】(15分)许多金属及它们的化合物在科学研究和工业生产中具有许多用途 回答下列有关问题:(1)基态Ni核外电子排布式为_________












