(15分)甲醇来源丰富 价格低廉 运输贮存方便 是一种重要的化工原料 有着重要的用途和应用前景。⑴工
| (15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。 ⑴工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H=-90.8 kJ/mol。 CH3OH(g) △H=-90.8 kJ/mol。已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol H2(g) + 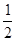 O2(g) = H2O(g) △H=-241.8 kJ/mol O2(g) = H2O(g) △H=-241.8 kJ/mol①H2的燃烧热为 ▲ kJ/mol。 ②CH3OH(g)+O2(g)  CO(g)+2H2O(g)的反应热△H= ▲ 。 CO(g)+2H2O(g)的反应热△H= ▲ 。③若在恒温恒容的容器内进行反应CO(g)+2H2(g)  CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。 CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。 ②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。 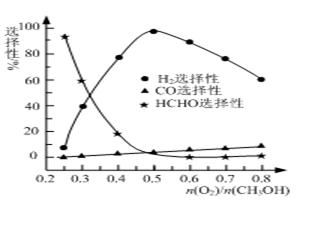 ⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。 |
参考解答
| ⑴①285.8 ②-392.8 kJ/mol ③AD ⑵①该反应是一个熵增的反应 (△S>0) ②2CH3OH+O2 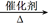 2HCHO+2H2O 0.5 2HCHO+2H2O 0.5⑶CH3OH-6e-+H2O=CO2↑+6H+ (除第⑴③3分外,其余每空2分,共15分) |
| (1)①燃烧热是指在25℃、101kPa下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,所以由方程式2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol 可得H2的燃烧热为285.8 kJ/mol; ②由方程式:CO(g)+2H2(g)  CH3OH(g) △H=-90.8 kJ/mol。 CH3OH(g) △H=-90.8 kJ/mol。2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol 根据盖斯定律可得:CH3OH(g)+O2(g)  CO(g)+2H2O(g) △H=-392.8 kJ/mol CO(g)+2H2O(g) △H=-392.8 kJ/mol③判断该反应达到平衡状态的本质是:正反应速率=逆反应速率;混合物中各组分的浓度不变。所以A、D正确,容器中H2浓度与CO浓度相等不一定达到平衡,B错;C错,该反应是等体积反应,无论反应是否达到平衡密度始终保持不变,不一定是达到平衡状态。 ⑵①CH3OH(g)  CO(g)+2H2(g)的正反应方向为吸热反应,该反应能自发进行的原因是该反应是一个熵增的反应 (△S>0); CO(g)+2H2(g)的正反应方向为吸热反应,该反应能自发进行的原因是该反应是一个熵增的反应 (△S>0);②当n(O2)/n(CH3OH)=0.25时,由图曲线分析可知主要是生成HCHO的反应,其反应的方程式为:2CH3OH+O2  2HCHO+2H2O;在制备H2时最好控制n(O2)/n(CH3OH)=0.5 2HCHO+2H2O;在制备H2时最好控制n(O2)/n(CH3OH)=0.5(3)关于燃料电池的电极反应方程式的写法原则:首先写燃料电池的总反应方程式,其反应的总反应方程式与燃料直接燃烧的方程式相同;第二步,再写正极电极反应,因为正极均为氧气得电子,在酸性溶液中其电极反应式为:O2+4e-+4H+=2H2O;第三步,将总反应方程式减去正极反应式得到负极电极反应式。 |
相似问题
酒精完全燃烧后 生成的产物可用一种物质完全吸收 这种物质是A.NaOH溶液B.碱石灰C.无水氯化钙D
酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是A.NaOH溶液B.碱石灰C.无水氯化钙D.浓硫酸
石油中常含有少量硫醇 因而产生难闻气味 硫醇是巯基(-SH)与链烃基相连的含硫有机物 其性质与醇类有
石油中常含有少量硫醇,因而产生难闻气味,硫醇是巯基(-SH)与链烃基相连的含硫有机物,其性质与醇类有相似之处。但是,由于巯基的存在,也导致硫醇有一
下列物质能使酸性KMnO4溶液褪色的是A.乙烯B.苯C.甲烷D.乙醇
下列物质能使酸性KMnO4溶液褪色的是A.乙烯B.苯C.甲烷D.乙醇
下表为某有机物与各种试剂的反应现象 则这种有机物可能是 A. CH2=CH-CH2-OH
下表为某有机物与各种试剂的反应现象,则这种有机物可能是 A CH2=CH-CH2-OHB C CH2=CH-COOHD CH3COOH
关于乙二醇和丙三醇的说法 错误的是( )A.乙二醇的水溶液凝固点很低 可作内燃机的抗冻剂B.丙三醇
关于乙二醇和丙三醇的说法,错误的是( )A.乙二醇的水溶液凝固点很低,可作内燃机的抗冻剂B.丙三醇的沸点比乙二醇的沸点高C.这两种多元醇易溶于乙












