(15分)乙醇 乙酸都是有机化工重要的基础原料。(1).空气中 乙醇蒸气能使红热铜丝保持红热 该反应
| (15分)乙醇、乙酸都是有机化工重要的基础原料。 (1).空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为 。 (2).浓硫酸催化下,乙酸和乙醇生成乙酸乙酯 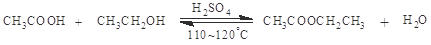 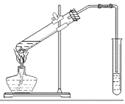 某化学兴趣小组的同学用以下装置进行该酯化反应的探究实验: ①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是 。 ②小试管中装的是浓Na2CO3溶液,导气管不插入液面下是为了防止 。 ③相关物质的部分性质:
⑤分离时,乙酸乙酯应该从仪器 (填“下口放” 或“上口倒出”)。 ⑥兴趣小组多次试验后,测出乙醇与乙酸用量和最后得到的乙酸乙酯生成量如下表:
|
参考解答
⑴2CH3CH2OH + O2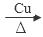 2CH3CHO + 2H2O 2CH3CHO + 2H2O(2)①大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙酸。②倒吸; ③不能,乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大。④分液漏斗 ;上口倒出 ⑤1.57-1.76mL; 探究乙酸用量对乙酸乙酯产量的影响。 |
试题分析:(1)空气中,乙醇蒸气能使红热铜丝保持红热,该反应的化学方程式为2CH3CH2OH + O2 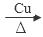 2CH3CHO + 2H2O; (2)①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是先向大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸,待溶液冷却后再加入2mL乙酸。②小试管中装的是浓Na2CO3溶液,其作用是吸收挥发的乙醇蒸气,反应消耗蒸发出来的乙酸,减少其气味的产生;降低乙酸乙酯的溶解度,以便于混合物的分离提纯。导气管不插入液面下是为了防止倒吸现象的发生。③不能用水替代小试管中的Na2CO3溶液,是因为乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大。④分离小试管中互不相溶的两层液体混合物的方法是分液,使用的仪器是分液漏斗。⑤在分离时,由于乙酸乙酯的密度比水小,在上层,使用应该从仪器上口倒出;⑥根据表中数据变化规律可知:表中数据X的范围是1.57-1.76mL;实验a与实验e中乙醇的用量相同,而乙酸用量不同,乙醇这两组使用探究的目的是探究乙酸用量对乙酸乙酯产量的影响。 2CH3CHO + 2H2O; (2)①要向大试管中加2mL浓硫酸、3mL乙醇、2mL乙酸,其具体操作是先向大试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸,待溶液冷却后再加入2mL乙酸。②小试管中装的是浓Na2CO3溶液,其作用是吸收挥发的乙醇蒸气,反应消耗蒸发出来的乙酸,减少其气味的产生;降低乙酸乙酯的溶解度,以便于混合物的分离提纯。导气管不插入液面下是为了防止倒吸现象的发生。③不能用水替代小试管中的Na2CO3溶液,是因为乙酸乙酯在乙醇、乙酸和水的混合溶液中溶解度比较大。④分离小试管中互不相溶的两层液体混合物的方法是分液,使用的仪器是分液漏斗。⑤在分离时,由于乙酸乙酯的密度比水小,在上层,使用应该从仪器上口倒出;⑥根据表中数据变化规律可知:表中数据X的范围是1.57-1.76mL;实验a与实验e中乙醇的用量相同,而乙酸用量不同,乙醇这两组使用探究的目的是探究乙酸用量对乙酸乙酯产量的影响。 |
相似问题
能较好说明乙醇分子结构简式为C2H5OH 而不是CH3OCH3的事实是( )A.乙醇与水以任意
能较好说明乙醇分子结构简式为C2H5OH,而不是CH3OCH3的事实是()A.乙醇与水以任意比例互溶B.乙醇无同分异构体C.1mol乙醇完全燃烧只生成2molCO2和3mol
一定条件下 用乙烷和乙烯制备氯乙烷(C2H5Cl)试回答下列问题:(1)用乙烷制备氯乙烷的化学方程式
一定条件下,用乙烷和乙烯制备氯乙烷(C2H5Cl)试回答下列问题:(1)用乙烷制备氯乙烷的化学方程式是_______________,该反应的反应类型是__________。(2
将铜丝放在酒精灯火焰上加热后 分别再将其放入下列溶液中 取出洗涤 干燥后质量不变的是:A.水B.乙醇
将铜丝放在酒精灯火焰上加热后,分别再将其放入下列溶液中,取出洗涤、干燥后质量不变的是:A.水B.乙醇C.盐酸D.石灰水
(1)(3分)通过实验事实的验证与讨论 认识苯的结构式。提出问题:苯分子结构是碳碳单双键交替的环状结
(1)(3分)通过实验事实的验证与讨论,认识苯的结构式。提出问题:苯分子结构是碳碳单双键交替的环状结构吗?①提出假设:从苯的分子式看,C6H6具有不
催化氧化的产物是的醇是( )
催化氧化的产物是的醇是( )












