(12分)在100 ℃时 将0.40 mol二氧化氮气体充入2 L抽空的密闭容器中 每隔一定时间就对
(12分)在100 ℃时,将0.40 mol二氧化氮气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
⑵此条件下该反应的化学平衡常数的值约为___________(保留两位有效数字)。 ⑶若达到平衡后,降低温度,气体颜色会变浅,则该反应的平衡常数将____________(填“增大”、“减小”或“不变”)。  ⑷若在相同情况下最初向该容器中充入的是N2O4气体,要达到初始数据表中同样的平衡状态,N2O4的起始浓度是_______________;假设在80 s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线。 ⑸计算⑷中条件下达到平衡后N2O4的转化率__________________。 |
参考解答
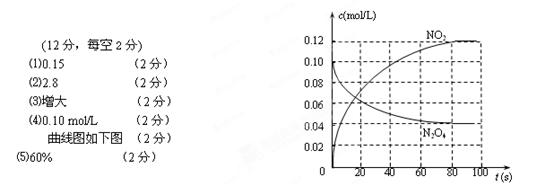 |
| 略 |
相似问题
在某恒定温度下 向容积为1 L的容器中投入1 mol CO和2 mol H2O 发生如下反应:CO(
在某恒定温度下,向容积为1 L的容器中投入1 mol CO和2 mol H2O,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),平衡时生成CO2 2/3 mol。若保
(8分)恒温下 将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中 发生如下
(8分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g)2NH3(g)(注:要求每步均要写出计
在25℃时 密闭容器中X Y Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是A.反应达到平衡
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是A.反应达到平衡时,X的转化率为50%B.反应可表示为X+3Y2Z,其平衡
一定温度下 对可逆反应A(g)+2B(g)=3C(g)的下列叙述中 能说明反应已达到平衡的是( )
一定温度下,对可逆反应A(g)+2B(g)=3C(g)的下列叙述中,能说明反应已达到平衡的是()A.A物质与C物质的反应速率之比为1∶2B.单位时间内消耗a mo
反应SO2(g)+ NO2(g) SO3(g)+NO(g) 若在一定温度下 将物质的量浓度均为2m
反应SO2(g)+ NO2(g) SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g












