(9分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O
(9分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。 2SO3(g)过程中的能量变化如图所示,回答下列问题。(1)T℃时将3mol  SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分) SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)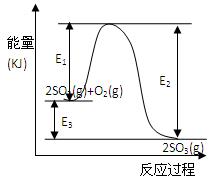 (2)下列叙述能证明该反应已达化学平衡状态的是 (填序号)(2分) ①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n mol  SO3 SO3 (3)反应 (填“放出”或“吸收”) 热量(用E1、E2或E3表示)(2分)。 (4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。 写出两电极的电极反应式: 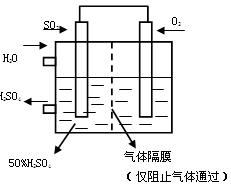 ; 。(2分) [来网]为稳定持续生产,硫酸溶液的浓度应维持不变,则通入S  O2和水的质量比为 (2分) O2和水的质量比为 (2分) |
参考解答
| (1)60%(1分) (2)①②③④(2分) (3)放热, E3或E2- E1、(2分) (4)+:O2+4e-+4H+  2H2O(1分) 2H2O(1分)-:2SO2-4e-+4H2O  2SO42-+8H+(1分) 16: 29(2分) 2SO42-+8H+(1分) 16: 29(2分) |
| 略 |
相似问题
(15分)某经济开发区将钛冶炼厂与氯碱厂 甲醇厂组成了一个产业链(如图所示) 大大地提高了资源利用率
(15分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。请填写下列空白:(1)写出钛
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)→Na2S(s)+4H2O
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)→Na2S(s)+4H2O(g)。下列说法正确的是( )A.该反应的平衡常数表达式K=c(H2O) c(H2)B.若容
在密闭容器中 下列可逆反应达到平衡后 升高温度可以使混合气体平均相对分子质量减小的是A.H2(g)+
在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均相对分子质量减小的是A.H2(g)+Br2(g)2HBr(g)ΔH<0B.N2(g)+3H2(g)2NH3
(5分)在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L
(5分)在一小烧杯里混合10ml 0 01mol L FeC13溶液和10ml 0 01mol L KSCN溶液,溶液立即变为红色。(1)再向溶液中滴入1mol LFeC13溶液,现象,平衡
(每空2分 共18分)在实验室中做如下实验:一定条件下 在容积为2.0L的恒容密闭容器中 发生如下反
(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2 0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);?△H=QkJ mol(1)若A、B起












