一定条件下 在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)CH3OH(g)达到化学平衡状态
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。 CH3OH(g)达到化学平衡状态。(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 增大压强K值将 (填“增大”、“减小”或“不变”)。 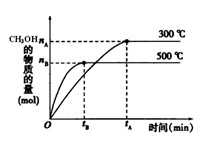 (2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nA 、nB、 tA 、tB表示)。 (3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。 a. v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变 c.混合气体的平均相对分子质量不再改变 d. CO、H2、CH3OH的浓度均不再变化 (4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。 a. c(H2)减少 b正反应速率加快,逆反应速率减慢 c. CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小 |
参考解答
(1)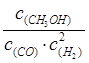 (2分)减小(1分)、不变(1分) (2) (2分)减小(1分)、不变(1分) (2)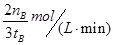 (2分) (3)cd(2分) (4)cd(2分) (2分) (3)cd(2分) (4)cd(2分) |
:(1)①化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数表达式是K=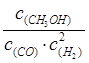 。 。②根据图像可知,温度越高,甲醇的含量越低。说明升高温度,平衡想逆反应方向越低,即正反应是放热反应,K值减小 K值只与温度有关,加压时其值不变 (2)500℃时,在tB时达到平衡,CH3OH的物质的量为nB,以甲醇来表示的反应速率为 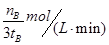 ,由反应系数之比可知,氢气的反应速率为 ,由反应系数之比可知,氢气的反应速率为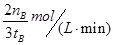 (3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。 a. v生成(CH3OH)、v消耗(CO)均表示的为正反应速率,并不能说明正逆反应速率相等,排除 b.在恒容情况下,反应混合气体的质量为定值,密度必为定值,不能做为平衡的判定标志 c.混合气体的质量为定值,但总物质的量一直在改变,故当混合气体的平均相对分子质量不再改变时,平衡达到平衡状态,正确 d. 符合平衡状态的概念,正确 (4)300℃时,将容器的容积压缩到原来的1/2,各物质浓度均增大,正逆反应速率均增大;压强增大,平衡正向移动,CH3OH 的物质的量增加,H2的物质的量减小,重新平衡后,c(H2)/ c(CH3OH)减小 故选cd |
相似问题
对于反应2SO2(g)+O2 (g)2SO3(g)(放热反应) 下列判断正确的是A.2体积SO2和足
对于反应2SO2(g)+O2 (g)2SO3(g)(放热反应),下列判断正确的是A.2体积SO2和足量O2反应,生成2体积SO3B.其他条件不变,降低温度,正反应速率增
(6分)等物质的量的A B混合于2L的密闭容器中 发生如下反应:3A(g)+B(g)xC(g)+2D
(6分)等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5 min后,测得D的浓度为0 5 mol L,c(A):c(B)=3:5,C的
在容积为1L的密闭容器中充入1mol CO和2mol H2混合气体 发生以下反应:CO(g)+2H2
在容积为1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:CO(g)+2H2(g)CH3OH(g)。T1、T2温度下,CH3OH的物质的量随着时间的变化关系
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g)+1025 kJ
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g)+1025 kJ (1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填
可逆反应: 下列分析一定正确的是 A.若升高温度气体的平均相对分子质量减小 则B C一定都为气体 B
可逆反应:,下列分析一定正确的是 A.若升高温度气体的平均相对分子质量减小,则B、C一定都为气体 B.若B为气体,C为非气体,则平衡后向恒容密闭容器












