工业上用粉碎的煤矸石(主要含Al2O3 SiO2及铁的氧化物)制备净水剂BAC〔Al2(OH)nCl
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC〔Al2(OH)nCl6-n〕的流程如下: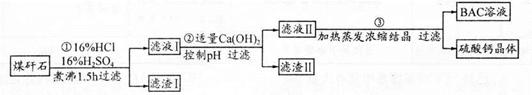 (1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。 (2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______(填化学式);随后溶液又变为棕黄色,相关离子反应方程式为______; 步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。 (3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________;巳知BAC的分散质粒子大小在1 nm?100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。 (4)若0.1 molAlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。 |
参考解答
| (15分)(1)增大反应物接触面积,加快溶解速率(提高Al3+的浸出率)(2分)SiO2(1分) (2)Fe2+(1分)4Fe2++O2+4H+=4Fe3++2H2O(2分)冷凝、回流(1分) (3)除Fe3+(2分)用一束光照射液体,观察是否产生丁达尔现象(或丁达尔效应)(2分) Al3++4OH-=AlO2-+2H2O(2分) (4)AlCl3(aq)+3H2O(l) 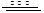 Al(OH)3(aq)+3HCl(aq) △H=+200akJ/mol(2分) Al(OH)3(aq)+3HCl(aq) △H=+200akJ/mol(2分) |
试题分析: (1)将煤矸石粉碎可增大反应物接触面积,加快溶解速率。二氧化硅不溶于盐酸、硫酸,滤渣I为二氧化硅。 (2)呈绿色的离子是Fe2+,随后Fe2+酸性条件下被空气中氧气氧化为Fe3+。长导管的作用是冷凝、回流。 (3)由分散质粒子直径可知BAC为胶体,区分溶液和胶体可根据胶体能产生丁达尔效应、溶液不能产生丁达尔效应。加氢氧化钙的目的是调节pH使Fe3+沉淀,若氢氧化钙过量,则发生Al3++4OH-=AlO2-+2H2O,使BAC产率偏低。 (4)反应0.005molAlCl3吸热akJ,所以反应1molAlCl3时吸热200akJ。 |
相似问题
下列离子的检验方法合理的是( )A.向某溶液中滴入KSCN溶液呈红色 说明不含Fe2+B.向某溶液
下列离子的检验方法合理的是( )A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有F
图中三位同学正在讨论某一物质 他们所描述的物质是A.HClB.S02C.CO2D.Cl2
图中三位同学正在讨论某一物质,他们所描述的物质是A.HClB.S02C.CO2D.Cl2
实验室有几瓶标签脱落的无色液体:己烯 苯 乙醇 苯酚溶液 若不依靠嗅闻的方法(反应条件可自由选择)
实验室有几瓶标签脱落的无色液体:己烯、苯、乙醇、苯酚溶液,若不依靠嗅闻的方法(反应条件可自由选择),只用一种试剂即可一一鉴别,则该试剂可能是( )A
(16分)某只含有CaCl2和Na2SO4杂质的粗盐样品 加水得到混合物A后 某实验小组的同学设计了
(16分)某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。(1)在混合物A中先加
下列除去杂质的方法正确的是( )A.除去CO2中混有的CO:用NaOH溶液洗气B.除去铜器表面
下列除去杂质的方法正确的是( )A.除去CO2中混有的CO:用NaOH溶液洗气B.除去铜器表面的铜绿[Cu2(OH)2CO3]:用硝酸浸泡,再用清水冲洗C.除去KNO3晶体












