海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:根据上述流程图 回
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图: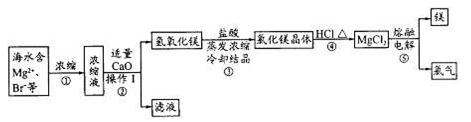 根据上述流程图,回答下列问题: (1)操作I的名称是 。 (2)步骤中②反应的化学方程式为 。 (3)步骤④中加热时通入HCl气流的作用是 。 (4)步骤⑤的离子反应方程式为 。 (5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。 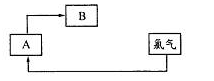 |
参考解答
(1)过滤(1分) (2)CaO+H2O=Ca(OH)2(1分) MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) (1分) (3)增大HCl浓度抑制MgCl2的水解(1分) (4)Mg2++2Cl-  Mg+Cl2↑(2分) Mg+Cl2↑(2分)(5)滤液(或浓缩液) Br2(2分,各1分) |
试题分析: 海水中主要有Na+,Cl-,Mg2+,Br-,SO42-等离子,蒸发浓缩后取浓缩液加CaO后会产生Mg(OH)2↓,进行过滤,滤液中当然含有Na+,Cl-,Br-,SO42-等离子。取所得的Mg(OH)2加HCl后进行浓缩结晶得到MgCl2晶体。再在HCl氛围中加热使其失去结晶水,得到MgCl2后,在进行电解得到Mg和Cl2。 (1)将固体和液体分开采用过滤(2)步骤中②反应的化学方程式为CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(3)步骤④中加热时通入HCl增大HCl浓度,在HCl氛围中,抑制MgCl2的水解,不能直接加热,否则MgCl2晶体会发生水解得到Mg(OH)2(4)步骤⑤的离子反应方程式为Mg2++2Cl-  Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2 Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2 |
相似问题
食盐溶液中存在Ca2+ Mg2+ SO42-等杂质 除杂时加入NaOH Na2CO3 BaCl2和盐
食盐溶液中存在Ca2+、Mg2+、SO42-等杂质,除杂时加入NaOH、Na2CO3、BaCl2和盐酸,下列添加试剂顺序正确的有①NaOH BaCl2 Na2CO3 HCl②BaCl2 HCl NaO
有一包白色固体粉末 由Na2SO4 CaCO3 KCl BaCl2 CuSO4中的三种物质组成 取样
有一包白色固体粉末,由Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的三种物质组成,取样进行如下实验:I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白
把少量的溴水注入KI溶液中 经充分反应后 加入CCl4用力振荡 静置后可观察到A.液体分成两层 下层
把少量的溴水注入KI溶液中,经充分反应后,加入CCl4用力振荡,静置后可观察到A.液体分成两层,下层呈紫色B.液体分成两层,上层呈紫色C.混合液不分层,
如果你家里的食用花生油混有水分 你将采用下列何种方法分离( )A.过滤B.蒸馏C.分液D.萃取
如果你家里的食用花生油混有水分,你将采用下列何种方法分离()A.过滤B.蒸馏C.分液D.萃取
下列分离物质方法不正确的是 A.用过滤的方法除去粗盐水中悬浊的泥沙B.用蒸馏的方法将自来水制成蒸
下列分离物质方法不正确的是A.用过滤的方法除去粗盐水中悬浊的泥沙B.用蒸馏的方法将自来水制成蒸馏水C.用酒精萃取的方法将碘水中的碘富集D.用淘洗的












