对于氧化还原反应: 2MnO4—+10Cl—+16H+2Mn2++5Cl2+8H2O (1)试将反应
对于氧化还原反应: 2MnO4—+10Cl—+16H+ 2Mn2++5Cl2+8H2O (1)试将反应拆分成两个电极反应,写出电池符号,并判断标准状态下此反应进行的方向。 (2)若c(H+)=0.0100mol.L—1,p(Cl2)=1000kPa,其他离子浓度为1.00mol.L—1,求此电池在298K时的电动势,并判断反应方向。 (3)求此反应的标准平衡常数。
2Mn2++5Cl2+8H2O (1)试将反应拆分成两个电极反应,写出电池符号,并判断标准状态下此反应进行的方向。 (2)若c(H+)=0.0100mol.L—1,p(Cl2)=1000kPa,其他离子浓度为1.00mol.L—1,求此电池在298K时的电动势,并判断反应方向。 (3)求此反应的标准平衡常数。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:(1)负极反应:2Cl—→Cl—+2e—正极反应:MnO4—+8H++5e—→Mn2++4H2O电池符号为:(—)Pt|Cl—(p)|Cl2(c2)||MnO4—(c2)Mn2+(c3)H+(c4)|Pt(+)查得:φΘ(MnO4—/Mn2+)=1.507VφΘ(Cl2/Cl—)=1.35827VEΘ=φ+Θ—φ—Θ=1.507V—1.35827V=0.149V>0故在标准状态下反应正向自发进行。(2)根据Nernst方程可得: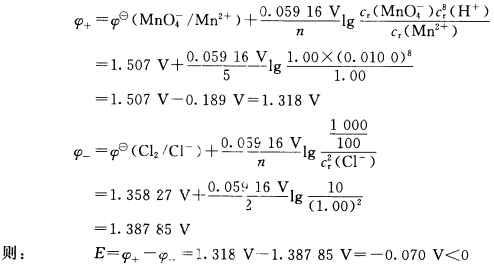 故在此条件下反应将逆向自发进行。
故在此条件下反应将逆向自发进行。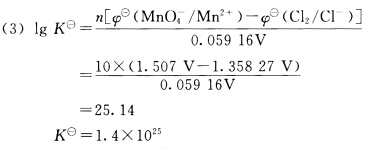
(1)负极反应:2Cl—→Cl—+2e—正极反应:MnO4—+8H++5e—→Mn2++4H2O电池符号为:(—)Pt|Cl—(p)|Cl2(c2)||MnO4—(c2),Mn2+(c3),H+(c4)|Pt(+)查得:φΘ(MnO4—/Mn2+)=1.507V,φΘ(Cl2/Cl—)=1.35827VEΘ=φ+Θ—φ—Θ=1.507V—1.35827V=0.149V>0故在标准状态下,反应正向自发进行。(2)根据Nernst方程可得:故在此条件下反应将逆向自发进行。
相似问题
分别计算氢电极在生物体液(pH≈7) 0.01mol.L—1HCl溶液 0.01mol.L—1NaO
分别计算氢电极在生物体液(pH≈7)、0.01mol.L—1HCl溶液、0.01mol.L—1NaOH溶液中电极电势(其他条件为标准状态)。请帮忙给出正确答案和分析,谢谢!
在一个氧化还原反应中 若两电对的电极电势值差很大 则可判断( )。A.该反应是可逆反应B.该反应的反
在一个氧化还原反应中,若两电对的电极电势值差很大,则可判断( )。A.该反应是可逆反应B.该反应的反应速率很大C.该反应能剧烈地进行D.该反应的反应
有关氧化值的叙述 不正确的是( )。A.单质的氧化值总是0B.氢的氧化值总是+1C.氧化值可为整数或
有关氧化值的叙述,不正确的是( )。A.单质的氧化值总是0B.氢的氧化值总是+1C.氧化值可为整数或分数D.多原子分子中各元素氧化值的代数和是0请帮忙给
计算在标准状态下进行氧化还原反应的平衡常数 必须先算出标准电动势。( )此题为判断题(对 错)。请帮
计算在标准状态下进行氧化还原反应的平衡常数,必须先算出标准电动势。( )此题为判断题(对,错)。请帮忙给出正确答案和分析,谢谢!
胶体系统能在一定程度上稳定存在的主要原因是什么?请帮忙给出正确答案和分析 谢谢!
胶体系统能在一定程度上稳定存在的主要原因是什么?请帮忙给出正确答案和分析,谢谢!












