某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。(1)CuSO4是重金属盐 能与蛋白质
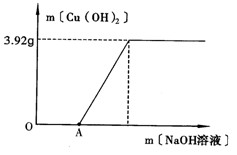
| 某环保小组监测到一工厂向河水中排放的酸性废液中含有CuSO4。 (1)CuSO4是重金属盐,能与蛋白质发生__________变化(选填“物理”、“化学”),使蛋白质失去原来的生理功能,所以CuSO4有毒。 (2)为了测定废液中CuSO4的质量分数,该小组取了100g废液,逐滴加入NaOH溶液至过量.测得生成Cu(OH)2沉淀(无其它沉淀)的质量与所加NaOH溶液的质量关系如下图所示: |
|
| ①说明图中的OA段未生成Cu(OH)2沉淀的原因。 ②计算废液中CuSO4的质量分数(写出计算过程,结果保留1位小数)。 ③如果仍取100g废液,向其中逐滴加入过量的BaCl2溶液,充分反应后,过滤,将所得沉淀洗涤、干燥称得质量为mg,能否用含m的代数式表达废液中CuSO4的质量分数?______(填“能”或“不能”)。 |
参考解答
| (1)化学 (2)①NaOH先与废液中的酸性物质反应 ②解:设废液中CuSO4的质量为x 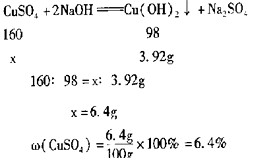 ③不能 |
相似问题
在烧杯中加入2.14g久置的铝箔 再滴加稀硫酸 放出气体的质量与所加稀硫酸质量的关系如下图所示。请回
在烧杯中加入2 14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如下图所示。请回答下列问题:(1)产生氢气________g,刚开始滴加稀
(本题有a b两小题 考生任选一题解答 不得两题都解。若两题都解 则以a小题计分)a.实验室要配制5
(本题有a、b两小题,考生任选一题解答,不得两题都解。若两题都解,则以a小题计分)a 实验室要配制50 g溶质质量分数为20%的硝酸钾溶液,现有25 g溶质质
请根据下图所示的实验过程和提供的数据 计算样品中钠元素的质量。已知:Na2CO3+CaCl2==Ca
请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量。已知:Na2CO3+CaCl2==CaCO3↓+2NaCl
黄铜是铜和锌的合金(Cu-Zn) 可用来制造电器零件及日用品。为测定某黄铜样品中铜的质量分数(不考虑
黄铜是铜和锌的合金(Cu-Zn),可用来制造电器零件及日用品。为测定某黄铜样品中铜的质量分数(不考虑黄铜中其他杂质),当向10g黄铜样品粉末中加入98g稀硫酸
我国是世界钢铁产量最大的国家 炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原
我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为:3CO+ Fe2O32Fe+3CO2(1)上述反应不是置换反应的