已知一块废弃的合金材料由金 铜两种金属组成 为了测定各成分的含量 技术人员将合金样品磨成粉末 取6.
| 已知一块废弃的合金材料由金、铜两种金属组成,为了测定各成分的含量,技术人员将合金样品磨成粉末,取6.3g该粉末在空气中加热使其充分反应,冷却后称量,样品质量增至7.7 g。试计算: (1)该合金材料中金的质量分数。 (2)若在灼烧后样品中加入稀硫酸使其恰好完全反应,然后再用铁将溶液中的铜置换出来,理论上需要消耗铁的质量是多少克? |
参考解答
| 解:(1)设6.3g样品中铜的质量为x。 2Cu+O2 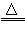 2CuO 2CuO2×64 32 x (7.7-6.3)g 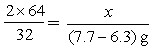 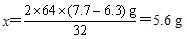 样品中金的质量分数为 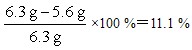 (2)设理论上需要消耗铁的质量为y。 CuO+H2SO4==CuSO4+H2O Fe+CuSO4==FeSO4+Cu 56 64 y 5.6g  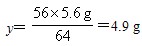 答:合金材料中金的质量分数为11.1%,理论上需要铁的质量为4.9g。 |
相似问题
26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应 反应后测得烧杯中剩余物的总质量为1
26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125 8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质
有盐酸和氯化铜的混合溶液共100 g 向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液 生成的沉淀与
有盐酸和氯化铜的混合溶液共100 g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液,生成的沉淀与加入的10% 的氢氧化钠溶液的质量关系如下图所示。若
为测定石灰石中碳酸钙的质量分数 化学兴趣小组的同学设计了以下方案:将94.9g稀盐酸加入到15g石灰
为测定石灰石中碳酸钙的质量分数,化学兴趣小组的同学设计了以下方案:将94 9g稀盐酸加入到15g石灰石样品中,恰好完全反应。生成的二氧化碳气体全部用足
某二价金属氧化物(MO)5g与45g稀硫酸恰好完全反应 测得反应后溶液中溶质的质量分数为30%。求:
某二价金属氧化物(MO)5g与45g稀硫酸恰好完全反应,测得反应后溶液中溶质的质量分数为30%。求:(1)该金属的相对原子质量。(2)稀硫酸中溶质的质量分数。
将26g某金属混合物投入到足量的稀硫酸中 共收集到2g氢气 该金属混合物的组成可能是[ ]A
将26g某金属混合物投入到足量的稀硫酸中,共收集到2g氢气,该金属混合物的组成可能是[ ]A Mg和ZnB Fe和ZnC Zn和CuD Cu和Fe












