为测定标示质量分数为32%的盐酸(图1)的实际质量分数 小明用pH测定仪组成实验装置(图2).实验时
为测定标示质量分数为32%的盐酸(图1)的实际质量分数,小明用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).发生反应的化学方程式为:NaOH+HCl=NaCl+H20.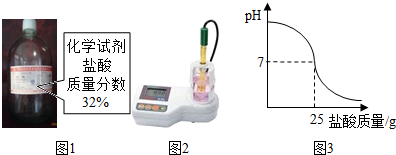 (1)请以此次测定的结果,列式计算该盐酸的实际质量分数; (2)请分析你的计算结果与标签标示的质量分数不一致的可能原因. |
参考解答
| (1)氢氧化钠和盐酸生成氯化钠和水,所以氢氧化钠和盐酸恰好完全时溶液的PH等于7,既20克氢氧化钠溶液和25克盐酸恰好完全反应.NaOH的质量=20克×40%=8克,设盐酸中的溶质的质量是X. NaOH+HCl=NaCl+H2O 40 36.5 8克 X
得:X=7.3克 ∴盐酸的溶质的质量分数=
(2)盐酸具有挥发性,所以溶液的中的溶质逐渐减少,溶剂不变,因此稀盐酸的浓度逐渐变稀.故答案为:盐酸具有挥发性. 答:盐酸的实际质量分数为29.2%. |
相似问题
已知“同温同压下 相同体积的任何气体所含分子数目都相同.”现有一定体积的氢气 氧气和氯气的混合气体
已知“同温同压下,相同体积的任何气体所含分子数目都相同.”现有一定体积的氢气、氧气和氯气的混合气体,在密闭容器中点火充分反应后,三种物质均无剩
实验室常用锌和稀硫酸反应制氢气.若制取0.2g氢气 需要锌的质量是多少?
实验室常用锌和稀硫酸反应制氢气.若制取0 2g氢气,需要锌的质量是多少?
根据化学方程式计算是由于( )A.化学方程式表示了一种化学反应过程B.化学方程式表示了参加反应的物
根据化学方程式计算是由于( )A.化学方程式表示了一种化学反应过程B.化学方程式表示了参加反应的物质是什么,反应后生成的物质又是什么C.化学方程
有一在空气中暴露过的KOH样品 经分析测知其含水7.62% 含K2CO32.38% KOH90% 若
有一在空气中暴露过的KOH样品,经分析测知其含水7 62%,含K2CO32 38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10 2%的KOH溶液中和过量的酸,则蒸发
为了探究化学反应中各物质之间的质量的关系 小敏同学做了五组氢气在氧气中燃烧的实验 实验结果记录如下:
为了探究化学反应中各物质之间的质量的关系,小敏同学做了五组氢气在氧气中燃烧的实验,实验结果记录如下:编号H2的质量 g0℃、101KPa下O2的体积 L生成H2












